再取进展!同济大学研究学者发现肺癌联合免疫治疗新靶点
| 导读 | 导致免疫检查点阻断(ICB)疗法耐药性的一个关键因素是肿瘤微环境(TME)中的CD8+ T细胞耐受性,部分原因是上调共抑制受体。 |
5月14日,同济大学附属东方医院郭忠良、王飞龙共同通讯在期刊《Cell Death Discovery》上在线发表题为“Deciphering the potential role of PGRN in regulating CD8+ T cell antitumor immunity”的研究论文,本研究为将这种新型联合疗法转化为肺癌免疫疗法的临床实践提供了创新的治疗策略和可靠的临床前数据。

https://www.nature.com/articles/s41420-024-02001-7
研究背景
01
基于免疫检查点阻断(ICB)的免疫疗法,包括抗程序性死亡1(PD-1)和抗程序性死亡配体1(PD-L1)的治疗,通过重新激活休眠的抗肿瘤T细胞效应反应,显著改变了肺癌的治疗格局。 然而,大多数患者由于原发性或获得性耐药而对单药α-PD-1/PD-L1治疗无反应。在这些病例中,PD-1信号转导不是癌症免疫周期的限制因素,仅阻断PD-1或PD-L1不足以恢复抗肿瘤免疫。其他免疫检查点、免疫抑制性免疫细胞、异常血管生成和细胞因子也在建立癌症-免疫平衡和促进免疫耐受方面发挥作用。因此,解决这些负面因素可以提高α-PD-1/PD-L1治疗的有效性并克服耐药性。
证据强调,CD8 +T细胞和肿瘤细胞之间的串扰决定了肿瘤的免疫状态,促进或阻碍了ICB的有效性。一般来说,肿瘤内浸润CD8 +细胞毒性T细胞(CTL)的数量越多,功能越强,对ICB的反应越好。 然而,CD8 +CTL细胞发挥强大的抗肿瘤功能,同时还被TME诱导逐渐产生免疫耐受,导致高水平的抑制检查点(即 CTLA-4、PD-1、LAG-3和TIM-3)的表达以及效应功能降低。这些因素导致ICB获得性耐药。 因此,克服获得性耐药应集中于缓解多种抑制机制和恢复耗尽的CD8 +T细胞,促进更强大的免疫反应。多种ICB的联合应用也显示出更高的临床疗效。
例如,临床试验表明,与标准靶向治疗、化疗或单药疗法联合伊匹木单抗或纳武利尤单抗相比,伊匹木单抗(抗CTLA-4)和纳武利尤单抗(抗PD-1)显示出更好的疗效。目前,除了恶性胸膜间皮瘤外,FDA还批准了这种治疗方案(伊匹木单抗联合纳武利尤单抗)用于黑色素瘤、PD-L1阳性NSCLC。 多种双重免疫检查点阻断策略,其中一些已获得FDA或NMPA批准,而另一些仍在临床试验中,包括α-PD-1/PD-L1与α-TIM-3、α-Siglec-15和α-LAG-3的组合。在ICB耐药方案的早期试验中,抑制这些靶点显示出积极的安全性和活性结果,无论是单独使用还是与PD-1或PD-L1抑制剂联合使用。因此,研究人员致力于寻找一种新的靶向分子,不仅可以恢复CD8 +T细胞的活性功能,打破TME诱导的T细胞免疫耐受,还可以开发新的抗PD-1/PD-L1联合治疗策略,以提高疗效。
研究发现
02
在这项研究中,研究人员利用小鼠肺癌模型阐明了PGRN是一种调节T细胞抗肿瘤反应的抑制分子,以及它作为肺癌联合免疫治疗策略靶点的潜力。最初,研究人员在皮下Lewis肺癌模型中观察到CD8 +肿瘤浸润淋巴细胞(TIL)中PGRN表达增加。随后的研究表明,PGRN敲除增强了宿主抗肿瘤免疫,抑制了肿瘤生长,并上调了CD8 +T细胞中趋化因子CCL3的表达。这促进了CD8 +T细胞在TME内的募集和积累,并增强了它们的增殖、活化和细胞毒性,同时延缓了耗竭,从而改善了抗肿瘤免疫反应。研究结果表明,PGRN消融加PD-L1阻滞剂对肺癌小鼠具有协同抗肿瘤作用。这种联合疗法通过增强TME中的CD8 +T细胞浸润和功能表现出卓越的抗肿瘤功效。
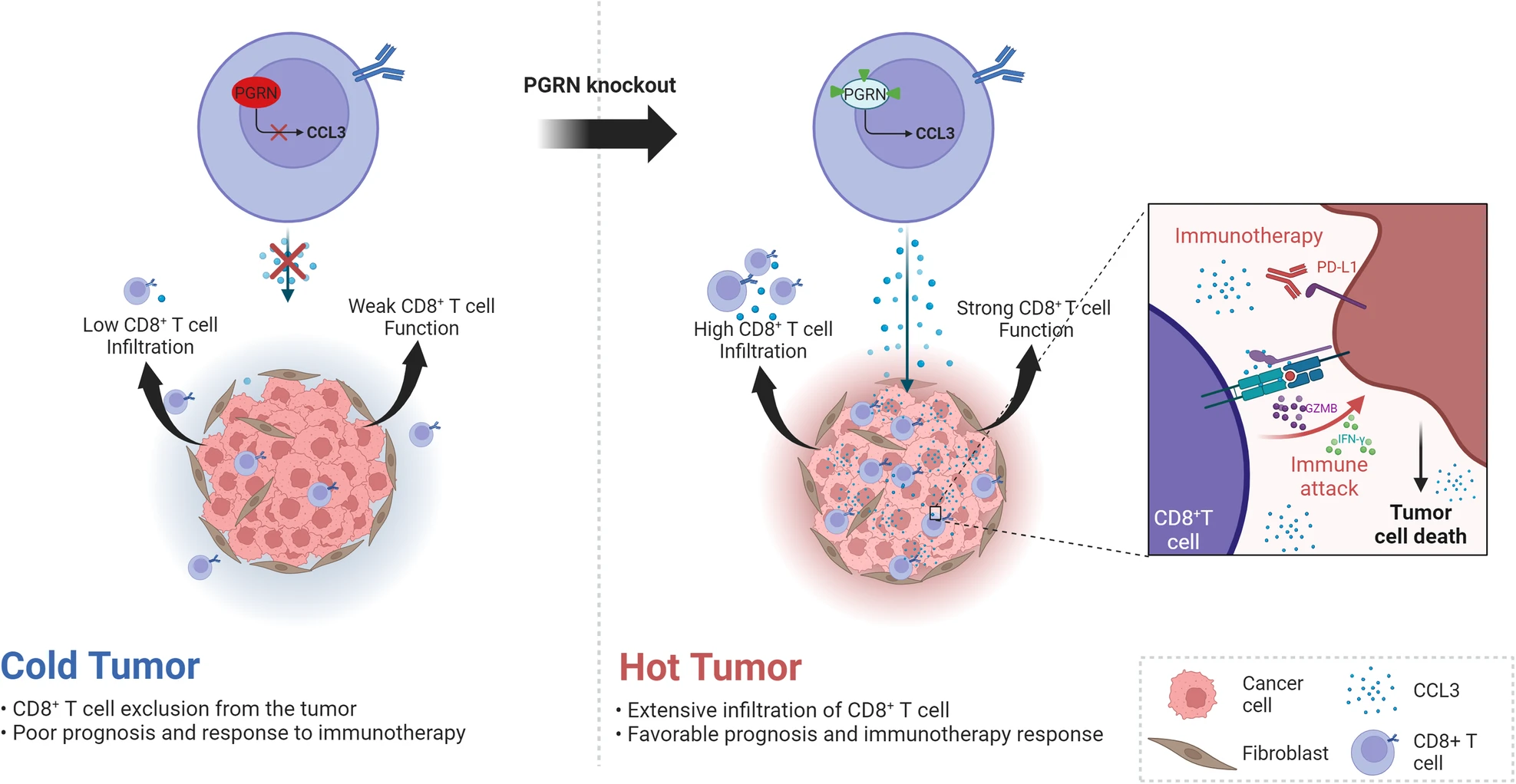
研究结论
03
综上所述,本研究为将这种新型联合疗法转化为肺癌免疫疗法的临床实践提供了创新的治疗策略和可靠的临床前数据。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41420-024-02001-7
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发