突破!曾木圣团队攻克KRAS突变癌症,推出革命性泛KRAS降解剂!
| 导读 | 在本研究中,团队开发了一种称为肿瘤靶向KRAS降解剂(TKD)的新型分子工具,可有效靶向多种KRAS突变体。 |
2024年6月28日,中山大学肿瘤防治中心曾木圣团队在《Cell Discovery》杂志发表了题为"A pan-KRAS degrader for the treatment of KRAS-mutant cancers"的研究论文。本研究的数据表明,TKD选择性地与癌细胞中的KRAS结合,并通过溶酶体依赖性过程,有效地诱导KRAS降解。在功能上,TKD抑制肿瘤生长,无明显副作用,增强PD-1抗体和西妥昔单抗的抗肿瘤作用。这项研究,不仅为开发靶向“不可成药”蛋白质的药物,提供了策略,而且还揭示了TKD是一种治疗KRAS突变癌症的有前途的治疗方法。
研究背景
01
据估计,在约20%的人类肿瘤细胞内,RAS基因发生了突变。其中,KRAS是最常见的突变致癌基因。肺腺癌 (LUAD)、胰腺导管腺癌(PDAC)和结直肠癌 (CRC) 具有高度致死性,并且表现出高频率的KRAS突变。突变率分别为32%、86%和41%。KRAS突变体,诱导下游信号级联反应的组成型激活,这不仅有助于肿瘤发展,而且削弱,甚至消除了靶向上游效应物(如表皮生长因子受体(EGFR))的药物的抑制作用。此外,KRAS突变体抑制干扰素调节因子2(IRF2)的表达,从而诱导癌症对免疫治疗的耐药性。
KRAS长期以来,一直被认为,是一种“不可成药”的蛋白质,因为它的球形结构、对GTP具有强亲和力,以及频繁的突变。这些特点,给使用传统策略开发靶向药物,带来了挑战。然而,最近的研究进展,已经确定了KRAS G12C突变体中的结合口袋(S-IIP),可以被小分子靶向。sotorasib和adagrasib等抑制剂,已被证明通过共价与该口袋相互作用,有效抑制G12C突变非小细胞肺癌(NSCLC)的生长。此外,一种名为MRTX1133的选择性KRAS G12D抑制剂,也可以与S-IIP口袋结合,但它与KRAS的相互作用是非共价的。另一种小分子抑制剂,通过阻断KRAS结合的GTP,和KRAS结合的GDP之间的核苷酸交换起作用,其已显示出对KRAS活性的广泛抑制。然而,其对水解活性受损的KRAS突变体(如KRAS G12R和Q61L/R/K)的有效性有限。值得注意的是,这些抑制剂的结合位点,对特定的KRAS突变体,或一类突变体具有特异性。此外,抑制剂对KRAS活性的极度抑制,往往导致不可预测的继发突变的出现。因此,有必要采取替代策略,来开发能够克服这些局限性的泛KRAS靶向药物。
破坏KRAS基因的表达,是消除KRAS突变致癌作用的有吸引力的策略。从理论上讲,DNA编辑和RNA干扰,都可以降低KRAS的表达。但这些策略的操作条件和脱靶效应,目前限制了它们的临床应用。选择性蛋白质降解,是减少癌细胞中KRAS的另一种有前途的策略。为此目的开发的一种技术,是蛋白水解靶向嵌合体(PROTAC)。PROTAC由两个片段组成:E3泛素连接酶的底物或配体,以及靶蛋白的配体。这些片段通过连接子,共价连接。通过将靶蛋白募集到E3连接酶中,PROTAC以蛋白酶体依赖性方式,促进其降解。之前的研究表明,使用这种方法,可以成功降解KRAS G12C突变体。蛋白质降解剂的另一个有吸引力的设计是 Trim-Away,它利用了E3泛素连接酶TRIM21对正常抗体Fc段的天然亲和力。Trim-Away将抗体-靶蛋白复合物募集到TRIM21中,从而诱导靶蛋白的泛素化和随后的蛋白酶体依赖性降解。Trim-Away的功能机制表明,KRAS降解剂可以基于对KRAS具有强亲和力的抗体构建。此外,AdPROM是另一种基于抗体的蛋白质降解剂,涉及将募集CUL2-RING E3连接酶复合物的von Hippel\u2012Lindau (VHL)蛋白与靶蛋白的高亲和力结合剂融合。使用逆转录病毒载体,可以将AdPROM引入靶细胞。使用基于GFP纳米抗体的AdPROM,可以成功降解敲入的绿色荧光蛋白(GFP)标记的KRAS蛋白。当GFP纳米抗体被HRAS单体取代时,降解剂还诱导了内源性未标记KRAS、HRAS和NRAS的强烈降低,表明基于单体的降解,对KRAS不具有特异性。这些发现,证明了使用基于抗体的方法,来设计针对KRAS的靶向药物的可行性。从理论上讲,基于抗体的KRAS降解剂,可以诱导pan-KRAS突变体的降解,因为抗体和抗原的结合,并不局限于特定位点。
基于蛋白质的靶向药物,如西妥昔单抗和帕博利珠单抗,已被广泛应用于癌症治疗。但几乎所有基于蛋白质的药物,都在细胞外空间起作用。为了成功进入细胞,并抑制细胞内靶标的活性,基于蛋白质的药物,尺寸应该很小,结构应该不复杂,以及拥有有效的细胞穿透肽(CPP)。纳米抗体是源自羊驼的抗体重链的可变结构域,其质量数约为15kD,远小于传统抗体(约150kD)。因此,纳米抗体可以很容易地穿透各种组织,并且可以使用原核或真核蛋白质,表达系统生产。纳米抗体是构建新型靶蛋白降解剂的理想平台。
之前的研究表明,来源于布福林IIb的无毒肽BR2,可以选择性地快速、特异性地识别和进入癌细胞。此外,可被溶酶体识别和结合的CTM肽,已被用于诱导靶蛋白的选择性降解。因此,我们采用了一种不同与以往使用的选择性蛋白质降解剂的方法,构建了一种基于靶向KRAS的纳米抗体的新型KRAS降解剂,并将其命名为肿瘤靶向KRAS降解剂(TKD)。TKD包含3个元素:癌细胞穿透肽BR2、与KRAS结合的纳米抗体,以及溶酶体识别和结合基序 CTM。团队研究了TKD在降解KRAS突变体和抑制肿瘤生长方面的作用。考虑到KRAS突变,被认为是免疫治疗和靶向治疗耐药性的有效驱动因素,团队进一步评估了TKD在使癌症对程序性细胞死亡蛋白1(PD-1)抗体和西妥昔单抗敏感方面的作用。

https://www.nature.com/articles/s41421-024-00699-4
研究进展
02
TKD抑制具有不同KRAS突变的癌细胞的生长
随后,团队探索了TKD的潜在抗癌活性。集落试验表明,在具有不同KRAS突变的癌细胞中,TKD抑制细胞增殖,但TKDm不抑制细胞增殖。进一步的CCK-8检测表明,TKD对具有不同KRAS突变的肺癌细胞、CRC细胞和PDAC细胞的生长,有显著的抑制作用,但对HRAS突变的癌细胞没有抑制作用。此外,团队构建了两种基于H358细胞系(含有KRAS G12C突变)稳定表达R68S/Y96C突变KRAS的adagrasib耐药细胞系。数据显示,R68S/Y96C突变,显著促进了H358细胞对adagrasib的耐药性,但TKD对这些耐药细胞,仍保持较强的抑制作用。
实验数据显示,TKD有效浸润肿瘤组织,表明TKD在体内癌症治疗中具有广阔的应用前景。TKD成功抑制了肿瘤生长。下游信号通路(pERK指示)的活性被抑制,表明TKD对自发性肿瘤,也有很好的治疗效果。
此外,团队比较了TKD和PROTAC LC-2在降解KRAS,和抑制具有不同KRAS突变的癌细胞生长方面的作用。与TKD相比,LC-2只能降解KRAS G12C突变体。此外,TKD可以抑制H358(KRAS G12C)或HCT116衍生肿瘤的生长,而LC-2只能抑制H358衍生的肿瘤生长。TKD还降低了HCT116和H358肿瘤中KRAS的表达,而LC-2仅降低了H358肿瘤中的KRAS表达。综上所述,TKD诱导KRAS降解,并抑制具有不同KRAS突变的癌细胞的生长。因此,TKD比PROTAC具有更广泛的应用。
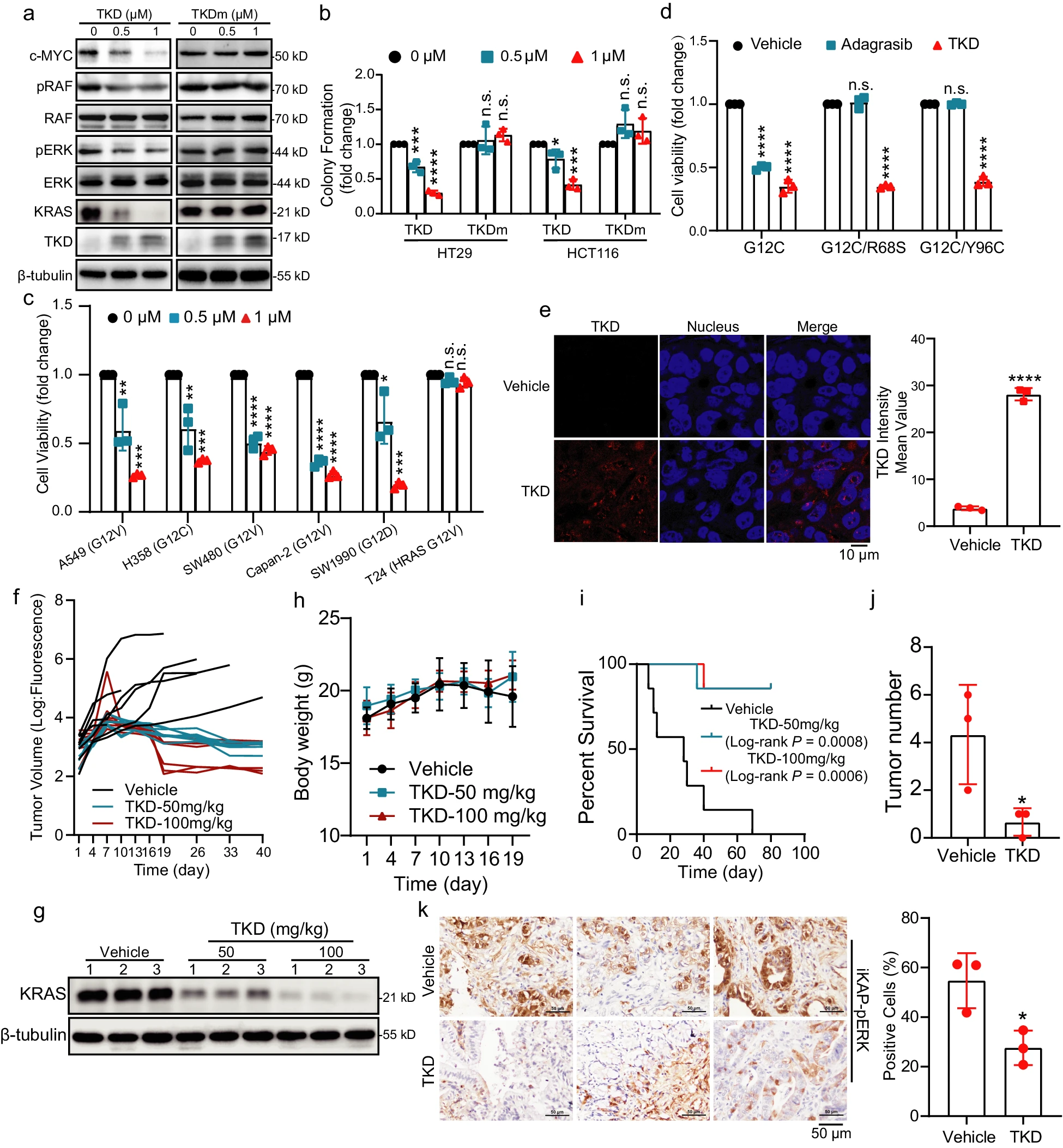
TKD抑制多种癌症的生长。
TKD使KRAS突变型CRC对PD-1抗体治疗敏感
之前的研究表明,KRAS突变抑制干扰素调节因子2(IRF2)的表达。IRF2是一种抑制髓源性抑制细胞(MDSC)迁移到肿瘤微环境的转录因子,并促进程序性死亡配体1(PD-L1)的表达,从而在肿瘤中产生免疫抑制微环境。考虑到TKD显著诱导突变KRAS降解,团队探讨了TKD在CRC免疫检查点阻断(ICB)治疗中的作用。Western blotting试验证实,TKD处理的癌细胞中的KRAS 降解,导致HCT116细胞中IRF2的增加和PD-L1的减少。流式细胞术检测还表明,在TKD处理的细胞中,细胞表面的PD-L1表达显著降低。因此,TKD可用于逆转突变KRAS诱导的免疫抑制。团队探索了MC38K细胞中TKD的活性,MC38K细胞是一种稳定表达KRAS G12D的小鼠CRC细胞系。数据显示,TKD处理抑制了KRAS的降解和细胞生长。在TKD治疗的肿瘤中,细胞毒性T细胞(CD45CD3CD8)的数量增加,MDSCs(CD45CD11bGr-1)的数量减少,表明TKD逆转了KRAS突变驱动的肿瘤中的免疫抑制。然后,团队单独或联合用TKD或PD-1抗体治疗小鼠。结果显示,联合治疗组禁止肿瘤生长。PD-1抗体和TKD组合的抑制作用,具有协同作用。在PD-1抗体和TKD联合治疗的肿瘤中,细胞毒性T细胞(CD8)积累,而MDSCs(Gr-1)的数量减少。重要的是,对照组和PD-1抗体治疗组,发生严重CRC肝转移,但TKD治疗组和联合治疗组无癌转移,表明TKD显著抑制了CRC的进展。总之,TKD是一种很有前途的药物,可以恢复肿瘤免疫微环境,并增强ICB治疗效果。
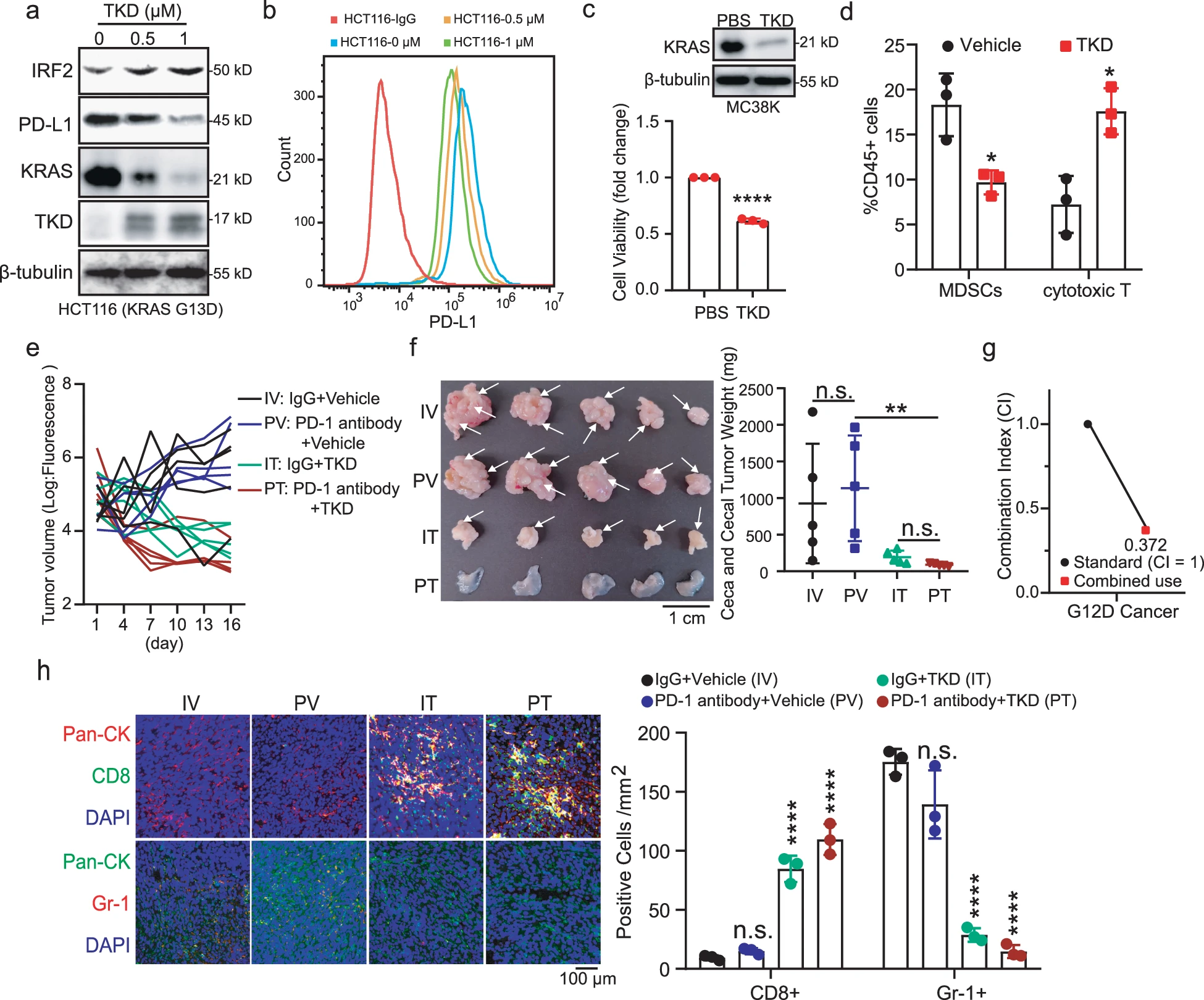
TKD恢复免疫微环境,改善ICB治疗。
TKD与西妥昔单抗联合治疗KRAS突变型结直肠癌,
具有良好的疗效
最近的一项研究表明,将KRAS G12C抑制剂与EGFR抗体西妥昔单抗,联合用于KRAS G12C突变CRC患者,具有抗肿瘤活性。此外,蛋白质组学分析还表明,TKD处理可以抑制EGFR信号通路的活性。因此,团队使用含有不同KRAS突变体的临床CRC组织,构建了患者来源的肿瘤异种移植物(PDX)模型,并在KRAS突变CRC PDX模型中,检查了西妥昔单抗和TKD的组合。数据显示,KRAS G12D和G12V肿瘤的生长,均受到协同抑制,G12D肿瘤的CI值为0.289,G12V肿瘤的CI值为0.137。此外,在G12D和G12V肿瘤中,与西妥昔单抗单药组相比,西妥昔单抗和TKD联合组的Ki-67阳性细胞,数量均减少。综上所述,PDX模型的结果表明,TKD在KRAS突变型CRC的临床治疗中,发挥着重要作用。
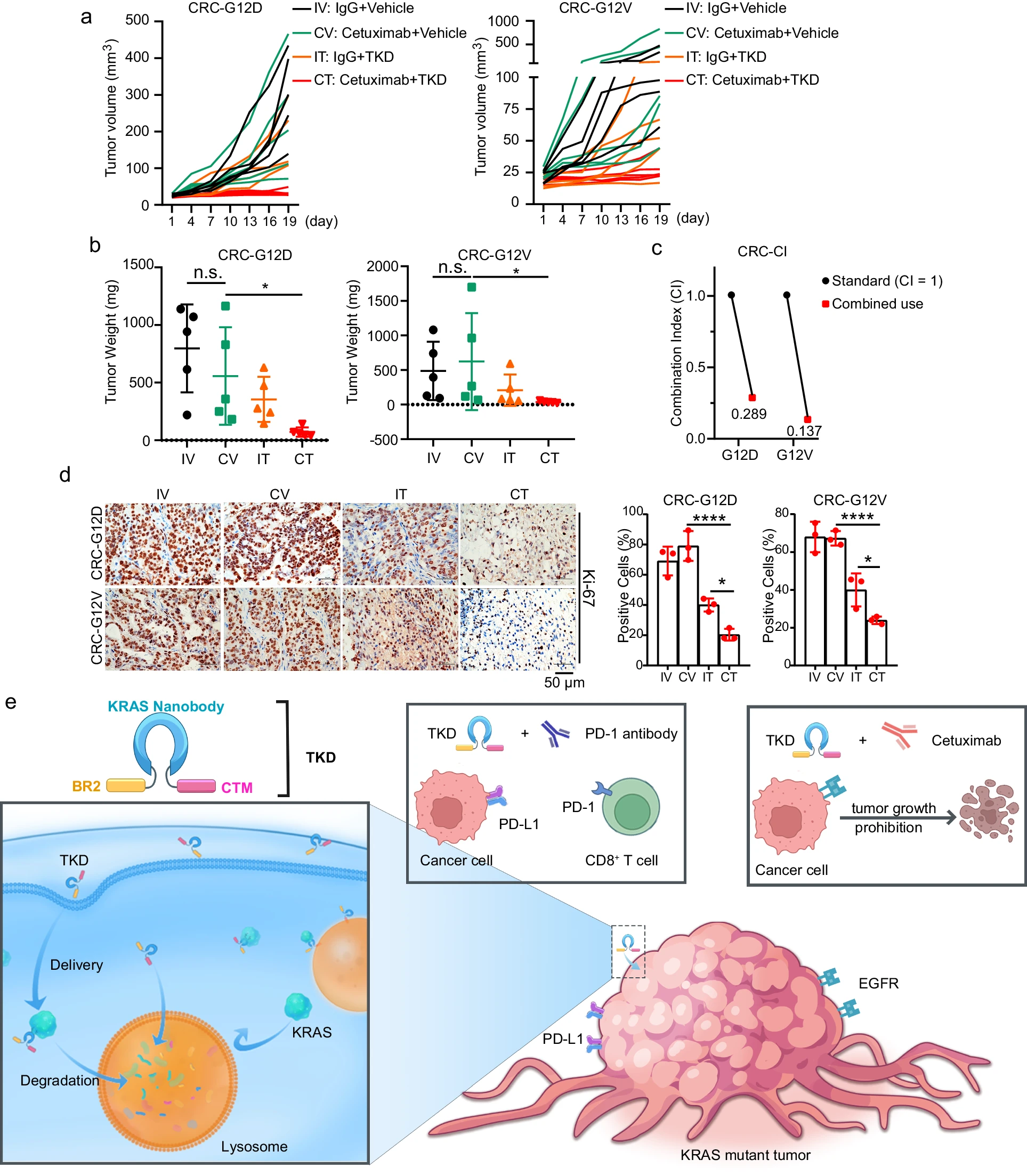
TKD和西妥昔单抗联合治疗KRAS突变CRC PDX小鼠模型。
研究结论
03
由于在G12X(G12C/G12D)突变体中发现了结合口袋(S-IIP),KRAS变得“可成药”。科学界已经开发了几种针对该口袋的抑制剂,目前正在进行临床试验,或已被批准用于临床治疗。除了G12C和G12D突变体外,大多数其他KRAS突变体,也被发现有助于癌症进展和耐药性。值得注意的是,癌细胞倾向于发展继发性KRAS突变,以抵消sotorasib和adagrasib等抑制剂的作用。团队通过将KRAS纳米抗体,与肿瘤靶向CPP和溶酶体结合基序融合,构建了一种称为TKD的泛KRAS靶向分子。TKD成功降解了不同的KRAS突变体,包括基于KRAS G12C的继发性突变,并在单独使用,或与其他批准药物联合使用时,抑制了KRAS突变体癌症的进展。结果表明,野生型KRAS也可以被TKD降解,但不必担心,其对正常组织的毒性,因为TKD表现出理想的肿瘤靶向能力。
TKD的小尺寸有助于降低其免疫原性和改善组织渗透。然而,它也会导致TKD的半衰期短。此外,当TKD通过内吞作用进入细胞时,一些TKD分子被溶酶体识别和降解,导致只有一部分TKD被释放到细胞质中以结合KRAS。此外,KRAS-TKD复合物的降解,导致细胞内TKD逐渐减少。因此,需要持续施用TKD,直到达到预期的治疗效果。团队的实验数据表明,定期给药TKD,无论是单独使用,还是与其他药物联合使用,都可以在KRAS突变癌症中,产生良好的治疗效果。各种化学修饰,如酰化和聚乙二醇化,可用于增强蛋白质药物的稳定性。一些生物材料,如水凝胶和脂质制剂,也可以延长蛋白质药物的半衰期。人血清白蛋白半衰期长(约19天),因此,白蛋白结合域,和TKD的融合,可能会延长TKD在血液中的循环时间。此外,一些肽已被证明可以有效地破坏内体膜,并促进内容物的释放。并且,这种肽在递送蛋白质中的应用,已显示出卓越的效果。这种肽与TKD的融合,也可以提高TKD递送的效率。
虽然已经有许多基于蛋白质的癌症治疗靶向药物,但大多数仍然靶向膜表面的癌蛋白。例如,人表皮生长因子受体2(HER2)和PD-1。除了治疗KRAS突变癌症外,本研究还为细胞内癌蛋白的靶向药物开发,提供了新的策略。从理论上讲,当TKD的纳米抗体元件,被靶向其他细胞内蛋白的纳米抗体取代时,该分子将成功降解靶蛋白,类似于TKD。因此,这种药物开发策略,可以充分利用“不可成药”的靶点,特别是那些已被证明在肿瘤进展中起重要作用的靶点,来设计靶向药物。这对于未来的癌症治疗,具有重要意义。
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发