【Nature子刊】北京大学杜晓娟团队:缓解肝癌耐药性的新机制
| 导读 | 超过一半的肝细胞癌(HCC)患者因化疗耐药而严重影响了化疗效果。然而,化疗诱导耐药基因上调的机制尚未完全阐明。 |
7月31日,北京大学杜晓娟研究团队在期刊《Cell Death&Disease》上发表了研究论文,题为“Chemotherapy-induced acetylation of ACLY by NAT10 promotes its nuclear accumulation and acetyl-CoA production to drive chemoresistance in hepatocellular carcinoma”,在这项研究中,研究人员揭示了一种新的机制,控制核酸乙酰辅酶A的产生,激活耐药基因在HCC中的转录。在HCC组织中,NAT10的表达上调,其上调与HCC患者的不良预后相关。NAT10也在耐药的HCC细胞中上调。靶向NAT10可增加HCC细胞和小鼠异种移植物对化疗的毒性。在化疗期间,NAT10从核仁转移到细胞核中,激活CYP2C9和PIK3R1的转录。此外,NAT10还特异性上调核酸乙酰辅酶A的表达。机制上,NAT10在细胞核中与ACLY结合,在K468位点乙酰化ACLY,以对抗SQSTM1-介导的降解。ACLY K468-Ac特异性地在细胞核中积累,通过增强H3K27ac来增加核酸乙酰辅酶A的产生,从而激活CYP2C9和PIK3R1的转录。值得注意的是,K468是ACLY在细胞核中定位所必需的。重要的是,HCC组织中ACLY K468-Ac的表达上调,敲除ACLY K468-Ac可增强HCC细胞和小鼠异种移植物对化疗的敏感性。这些研究结果共同表明,NAT10是一种新型的耐药驱动因子。阻断NAT10介导的ACLY K468-Ac具有缓解HCC耐药性的潜力。

https://www.nature.com/articles/s41419-024-06951-9#Sec12
背景知识
01
肝细胞癌(HCC)是全球第三大癌症死亡原因,每年约有60万人因此死亡。大多数HCC患者在晚期被诊断出来,失去了进行手术切除的机会。化疗和酪氨酸激酶抑制剂(TKIs)已成为晚期HCC患者的主要治疗手段。最近有报道称,基于化疗的肝动脉灌注(HAIC)可以避免经动脉化疗栓塞术(TACE)引起的缺氧,使HCC患者的总生存期延长5.1个月,比索拉非尼为基础的TKIs治疗效果更好,成为治疗晚期HCC患者的一种有前景的治疗手段。然而,约54%的HCC患者对化疗为基础的HAIC没有反应,因为存在化疗耐药性。因此,更好地了解化疗耐药的机制将为改善HCC的治疗效果提供新的策略。
化疗耐药是由药物转运、药物代谢、细胞存活信号通路和DNA损伤修复相关基因的转录上调引起的。在这些通路中,细胞色素P450 (P450)酶的表达和活性的增加通过促进药物在HCC中的代谢来降低全身药物水平。更重要的是,AKT信号通路的过度激活通过抑制凋亡和促进细胞存活来促进肝癌的化疗耐药。因此,这些基因的转录上调在化疗耐药中起着驱动作用。
基因转录通过组蛋白乙酰化激活,乙酰化中和组蛋白正电荷,从而放松组蛋白和DNA之间的相互作用,从而促进转录因子与启动子的结合。乙酰辅酶A (acetyl- coa)是蛋白质乙酰化的必需乙酰供体,而乙酰辅酶A对组蛋白乙酰化高度敏感。鉴于乙酰辅酶A是一种高能量且不稳定的分子,乙酰辅酶A在细胞核内的快速生成可能确保其在DNA损伤的化疗中用于组蛋白乙酰化。此外,乙酰辅酶A在不同的亚细胞区室中的丰度受到生理条件或应激的精确控制。因此,探索乙酰辅酶A核内产生的机制将有助于更好地理解在化疗耐药中基因转录的上调。
靶向NAT10可使肝癌细胞和小鼠异种移植瘤对化疗敏感
02
研究人员分析了人类蛋白质图谱(HPA)数据库中的免疫组化数据,评估了NAT10在人肝癌组织中的表达水平。与非肿瘤肝组织相比,NAT10在HCC肿瘤组织中表达上调。此外,NAT10高表达与较短的生存期相关,提示靶向NAT10可能改善HCC患者的预后。为了探索NAT10在肝癌化疗耐药中的作用,研究人员建立了Huh7- oxa -r细胞,发现NAT10在Huh7- oxa -r细胞中的表达较亲本细胞上调。研究人员以Huh7-NAT10 shRNA-1、Huh7-NAT10 shRNA-2和Huh7-control shRNA细胞为研究对象,检测了各组细胞对阿霉素和奥沙利铂的IC50。敲低NAT10降低了这些化疗药物的IC50。此外,敲低NAT10在OXA和多柔比星(DOX)处理下抑制肝癌细胞生长并诱导凋亡。这些结果表明靶向NAT10可使肝癌细胞对化疗增敏。另外,异位表达Flag-NAT10增强了肝癌细胞的化疗耐药性,而乙酰转移酶死亡突变体Flag-NAT10 G641E则无法做到这一点。这些结果表明,NAT10通过其乙酰转移酶活性促进HCC化疗耐药。
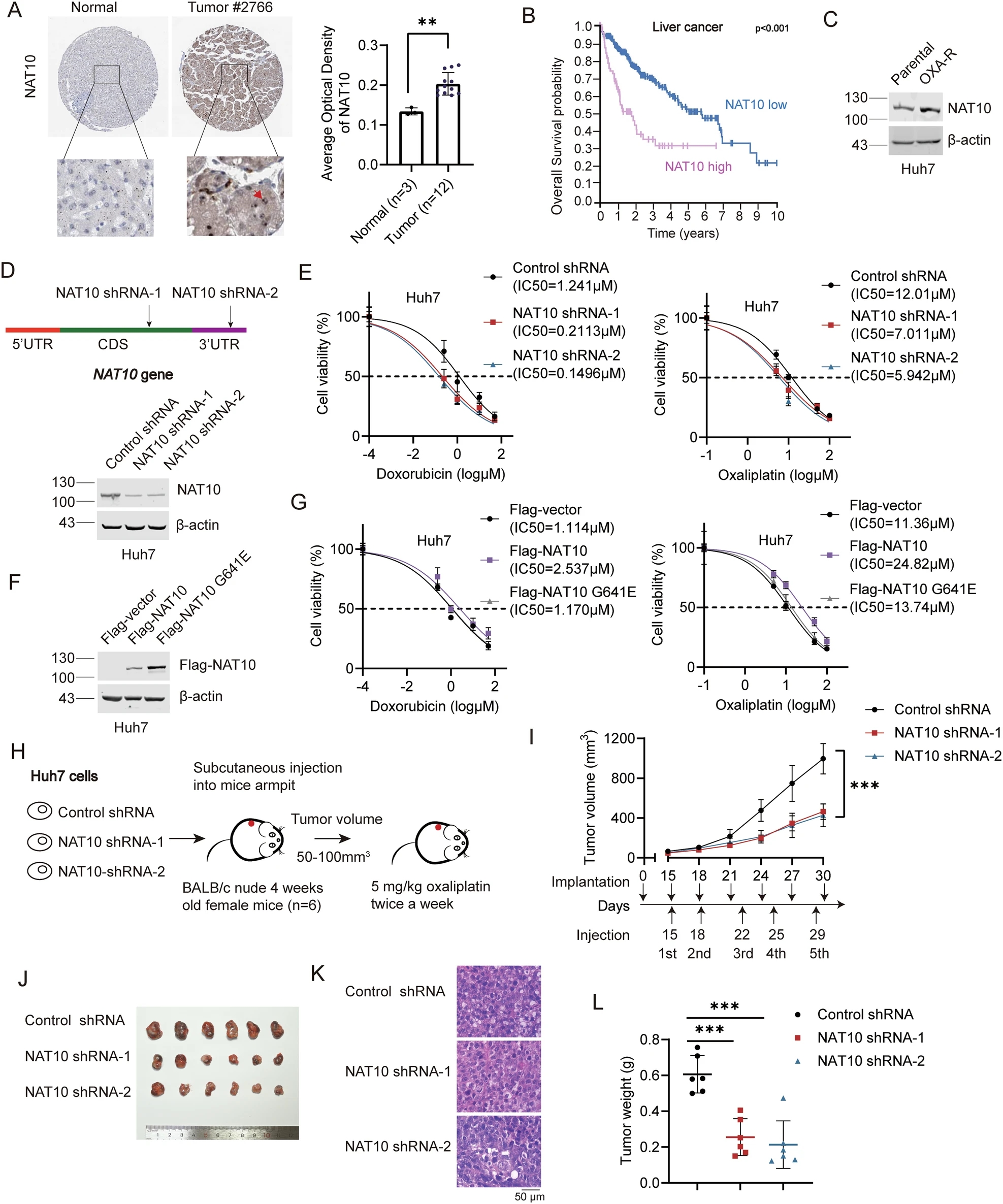
靶向NAT10使肝癌细胞和小鼠异种移植物对化疗增敏
为了进一步证实NAT10在体内化疗耐药中的作用,研究人员将Huh7-NAT10 shRNA-1、Huh7-NAT10 shRNA-2和huh7 -对照shRNA细胞皮下植入BALB/c裸鼠。当肿瘤体积达到50-100 mm3时,每周腹腔注射奥沙利铂2次,当肿瘤最大直径达到1.5 cm时结束实验。在小鼠异种移植瘤模型中,敲低NAT10可显著降低肿瘤体积和重量。因此,研究人员证明NAT10促进HCC细胞和体内的化疗耐药。
ACLY K468-Ac赋予HCC细胞和小鼠异种移植物化疗耐药性
03
为了确定ACLY K468-Ac是否控制HCC细胞的化疗耐药,研究人员测定了奥沙利铂和阿霉素在Huh7-GFP、Huh7-GFP-ACLY和Huh7-GFP-ACLY K468R细胞中的IC50值。奥沙利铂和阿霉素的IC50值在GFP-ACLY细胞中升高,而在GFP-ACLY K468R细胞中升高,表明ACLY K468-Ac驱动HCC的化疗耐药。为了进一步证实ACLY K468-Ac在体内化疗耐药中的作用,研究人员将Huh7-GFP、Huh7-GFP-ACLY和Huh7-GFP-ACLY K468R细胞皮下植入BALB/c裸鼠,并用奥沙利铂治疗小鼠。来自Huh7-GFP-ACLY的异种移植物肿瘤体积和重量显著增加,而来自Huh7-GFP-ACLY K468R的异种移植物肿瘤体积和重量显著增加,表明ACLY K468-Ac赋予HCC细胞和小鼠异种移植物化疗耐药性。PIK3R1和CYP2C9在小鼠异种移植物中的表达也通过ACLY K468-Ac上调。此外,与非肿瘤组织相比,HCC肿瘤组织中ACLY K468-Ac水平上调。这些结果表明ACLY K468-Ac驱动HCC的化疗耐药。
研究小结
04
总之,本研究揭示了化疗诱导的ACLY K468被NAT10乙酰化驱动HCC化疗耐药。抑制NAT10-ACLY K468-Ac轴为加强晚期HCC患者化疗疗效提供了一种有希望的策略。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41419-024-06951-9#Sec12
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发