“冷肿瘤”变“热肿瘤”!复旦大学侯宪玉/施国明教授团队:揭示癌症免疫治疗新策略
| 导读 | Arf1已被证实在支持肿瘤干细胞(CSCs)中发挥选择性作用,使其成为肿瘤治疗的一个有吸引力的靶点。然而,目前的Arf1抑制剂由于其高毒性和低特异性而限制了其翻译潜力。 |
9月3日,复旦大学侯宪玉/施国明教授团队在期刊《Advanced Science》上发表了研究论文,题为“Novel Arf1 Inhibitors Drive Cancer Stem Cell Aging and Potentiate Anti-Tumor Immunity”,本研究中,研究人员介绍了两种新的强效Arf1小分子抑制剂DU101和DU102,用于肿瘤治疗。临床前肿瘤模型表明,这些抑制剂在肿瘤干细胞中触发了衰老级联,并在小鼠肿瘤和PDX模型中增强了抗肿瘤免疫。通过单细胞测序,研究人员分析了这些新型Arf1抑制剂诱导的肿瘤免疫微环境重塑,并确定了肿瘤相关CD8+ CD4+双阳性T (DPT)细胞的增加。这些DPT细胞具有活化的CD8单阳性T细胞和较高比例的TCF1+PD-1+的干细胞样T细胞的特征。肿瘤浸润干性DPT细胞的频率与癌症患者较好的无病生存期(DFS)相关,表明这些抑制剂可能通过将冷肿瘤免疫微环境转化为热肿瘤免疫微环境,从而提供一种新的癌症免疫治疗策略,进而扩大了癌症患者的免疫治疗潜力。

https://onlinelibrary.wiley.com/doi/10.1002/advs.202404442
背景知识
01
Arf1是ADP-核糖基化因子(Arf)小G蛋白家族的成员,位于多种细胞器的结合部位。其功能包括协调细胞器间的通讯、脂肪酸代谢以及维持线粒体稳态。研究发现,Arf1在多种人类癌症中高表达,包括但不限于乳腺癌、肝细胞癌、结肠癌和前列腺癌。并且,Arf1表达水平的升高与癌症患者的预后呈负相关。
最近的研究揭示,Arf1-调控的脂质代谢在维持癌干细胞和神经元的稳态方面发挥着关键作用。在果蝇中,在肠道和马氏管(肾脏)的分化细胞中敲除Arf1不会产生明显的表型。然而,在干细胞中敲除Arf1会触发一系列细胞器衰老(具有衰老的标志),包括脂质滴(LD)积累、线粒体损伤、活性氧(ROS)产生、内质网(ER)压力和溶酶体蛋白质聚集。果蝇中异常的干细胞通过向邻近的肠上皮(EC)细胞传递危险信号来激活它们,从而通过杀伤、吞噬和清除的过程消除受损的干细胞。在小鼠中,在具有Alb-Cre的肝细胞或具有Lgr5-CreER的正常成年肠道干细胞中敲除Arf1不会产生表型,而在具有Lgr5-CreER的肠道癌干细胞或具有Axin2-CreER的肝脏癌干细胞中敲除Arf1则会触发类似的细胞器衰老级联反应。异常的CSC随后向肿瘤免疫微环境中的抗原呈递树突状细胞(DCs)发送危险信号以激活它们。与当前的治疗方法不同,Arf1-靶向疗法通过促进CSC衰老和增强免疫细胞的抗肿瘤活性提供了双重抗癌机制。然而,还需要进一步的研究来了解Arf1-靶向疗法调控的抗肿瘤免疫反应。
新型Arf1抑制剂的发现
02
研究人员利用果蝇干细胞肿瘤系统筛选并发现了两种新型高效的小分子Arf1抑制剂DU101和DU102,它们能够特异性且有效地杀死癌干细胞。研究人员首先验证了DU101和DU102对Arf1的生化和物理效应。据报道,与GDP结合的高尔基体相关Arf激酶激活因子(GBF1)的Sec7域与GDP结合的Arf1相互作用,以调节GDP-GTP交换以激活Arf1。研究人员进行了高精度分子对接分析,然后通过等温滴定量热法直接检测DU101或DU102与GBF1的Sec7域的结合效率。药物亲和力响应靶标稳定(DARTS)是一种基于靶标蛋白与小分子结合时稳定性变化的跟踪和识别靶标蛋白的方法。通过DARTS,研究人员证明DU101和DU102能够以剂量依赖的方式显著增强Arf1的稳定性。研究表明只有Arf1的蛋白质水平在用蛋白酶处理后与DU101或DU102共同处理的细胞中增加,表明Arf1的稳定性对这些抑制剂具有特定的保护作用。而测试的其他ARF同源物,包括Arf3、Arf5、Arf6和泛Ras,在用蛋白酶处理的细胞中与DU101或DU102处理组相比,其蛋白质水平没有明显差异。对于Arf1活性检测,GST-GGA3-PBD融合蛋白可特异性结合激活的GTP结合形式的Arf1,通过将GST-hGGA3-Arf1进行沉淀,可检测细胞中Arf1的活性。研究人员发现DU101或DU102治疗显著抑制Arf1活性。这些结果表明,新型Arf1抑制剂可以通过与Arf1和Arf-GEF结合来抑制Arf1活性。
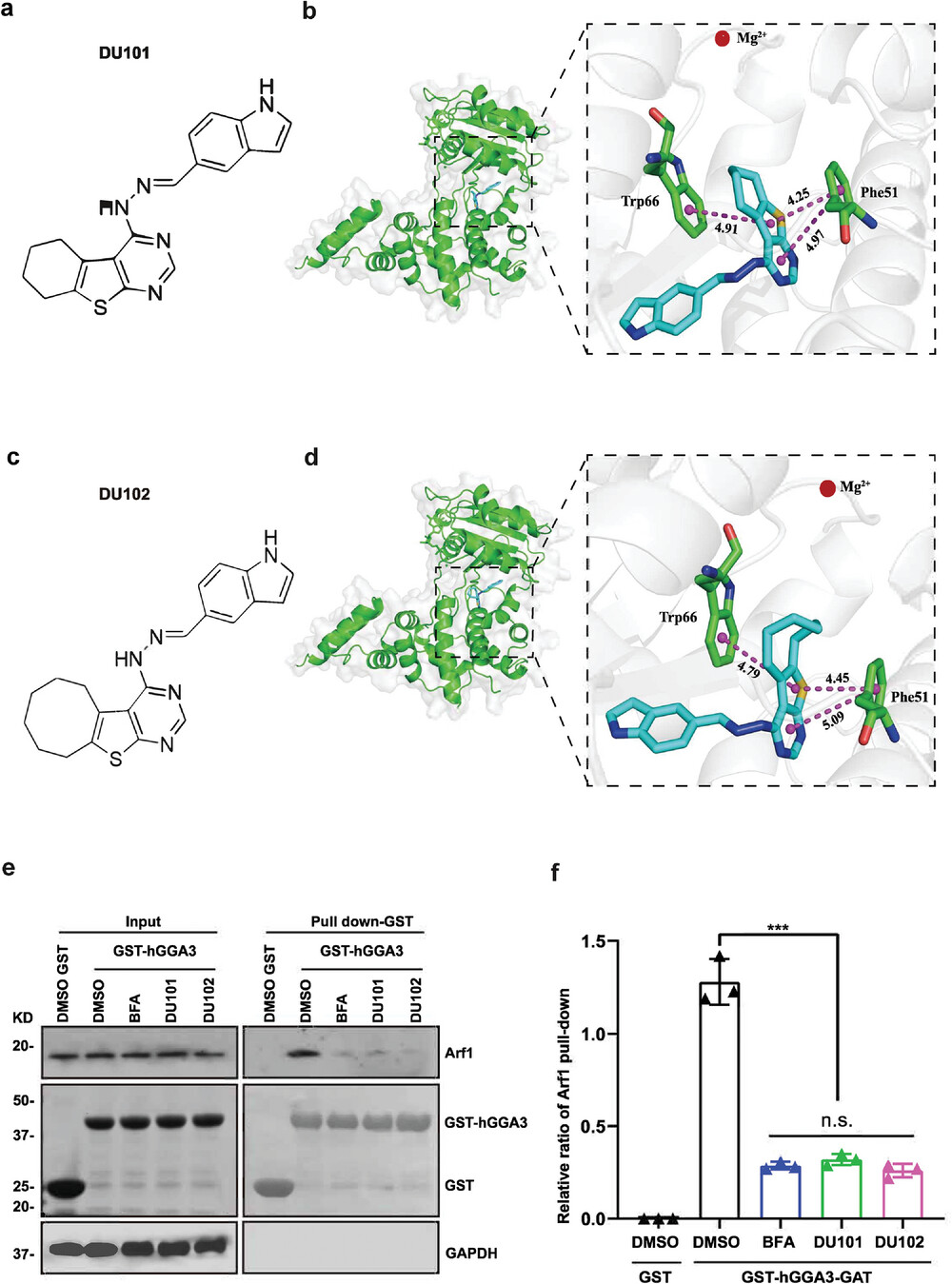
DU101和DU102是新型有效的Arf1抑制剂
为了评估DU101和DU102对细胞的毒性,研究人员检测了Drosophila正常干细胞以及CT26、4T1、B16-F10和LLC细胞在DMSO和DU101或DU102处理后的细胞活性,发现DU101和DU102的细胞毒性较低。为了评估体内毒性,研究人员比较了接受DU102治疗或未接受治疗的小鼠不同器官的组织学变化。通过苏木精-伊红(HE)染色,未发现显著的组织学改变。综上所述,这些结果表明这两种新型的Arf1抑制剂DU101和DU102的毒性较低,可能具有有效的Arf1抑制作用。
研究数据还表明,Arf1抑制剂可诱导抗肿瘤M1巨噬细胞的浸润、激活树突状细胞(DC),并减少促肿瘤M2巨噬细胞的浸润。因此,Arf1抑制剂促进了促炎性TME重塑,以支持抗肿瘤免疫。
研究小结
03
总之,本研究中新开发的Arf1抑制剂作为一种癌症免疫疗法的新策略,展现出了令人期待的前景。在前期的毒理学研究中,它们展现出了强大的药理学作用和积极的安全性特征。目前,一种改良后的DU101和DU102衍生物(AOB01)正在进行临床前研究,既作为单一疗法,也作为与抗PD-1药物联合治疗实体瘤的组合疗法。据知,这种新型的Arf1抑制剂是首个通过促进癌干细胞衰老和抗肿瘤免疫来激活双重抗癌疗法的药物,这为靶向这一双重过程的其他治疗方法奠定了基础。(转化医学网360zhyx.com)
【参考资料】
https://onlinelibrary.wiley.com/doi/10.1002/advs.202404442
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录




还没有人评论,赶快抢个沙发