复旦大学附属肿瘤医院胡夕春团队:HER2阳性实体瘤患者靶向抗体-药物DP303c的首次人体研究结果
| 导读 | 这是一项在中国进行的多中心、剂量递增和剂量扩展1期研究。 |
2024年9月12日,复旦大学附属肿瘤医院胡夕春团队在期刊《npj Precision Oncology》上发表了题为“First-in-human study of DP303c, a HER2-targeted antibody-drug conjugate in patients with HER2 positive solid tumors”的研究论文。研究结果表明,DP303c在既往治疗的晚期HER2阳性实体瘤患者中,表现出有希望的抗肿瘤活性和可接受的安全性,尤其是在乳腺癌中。

https://www.nature.com/articles/s41698-024-00687-7
研究背景
01
人表皮生长因子受体2(HER2)在20%-25%的乳腺癌、20%-30%的卵巢癌和15-20%的胃癌中过表达,并与攻击性行为、高复发风险和不良预后有关。几项研究表明,HER2靶向治疗,已被证明可以改善HER2阳性肿瘤的生存预后。到目前为止,中国有几种HER2靶向疗法可用,包括曲妥珠单抗、帕妥珠单抗、抗HER2酪氨酸激酶抑制剂(lapatinib、pyrotinib、niratinib)、抗体偶联药物(ADC、曲妥珠单抗emtansine、曲妥珠单抗 deruxtecan和disitamab vedotin)。尽管目前有可用的药物,但很大一部分晚期实体瘤患者在接受HER2靶向治疗后,出现进展性疾病。
ADC已成为一种快速增长的抗癌疗法,它被设计为一种高效的药物递送系统,使强效细胞毒素能够进入癌细胞,同时保留非恶性细胞,从而限制脱靶不良反应的风险。影响ADC活性的5个关键因素,是靶抗原、抗体、接头、细胞毒性有效载荷和偶联方法。到目前为止,ADC药物的开发,可以细分为三代,在鉴定新抗原、全人源化抗体、具有最佳毒性和旁观者效应的新有效载荷,以及设计新的连接子,以平衡稳定性和有效载荷释放方面,取得了更大的进展。
作为第二代HER2靶向ADC,DP303c由人免疫球蛋白G1(IgG1)抗HER2抗体(DP001)、一种基于酶的可切割肽接头和两种微管蛋白聚合抑制剂(MMAE)组成。DP001使用稳定的中国仓鼠卵巢(CHO)细胞系生产,与曲妥珠单抗具有相同的氨基酸序列。在这项研究中,团队报告了一项首次人体、1期、多中心、开放标签、剂量递增和剂量扩展研究,以评估DP303c在HER2阳性晚期实体瘤 (NCT04146610)患者中的安全性和耐受性、药代动力学、免疫原性和疗效。
研究进展
02
疗效
截至2023年2月28日,中位随访时间为12.0(范围1.7-35.2)个月。在91例可评估疗效的患者中,39例患者达到客观反应(42.9%,95%置信区间[CI] 32.5-53.7),包括32例确诊反应和7例未确认反应。1例反应(1/3,33.3%)发生在1.0mg/kg Q3W时,2例反应(2/6,33.3%)发生在2.0mg/kg Q3W时,32例反应(32/75,42.7%),4例反应(4/6,66.7%) 发生在4.0mg/kg Q3W时。在62例患者中,观察到疾病控制(68.1%,95%CI 57.5-77.5)。在39名达到完全缓解和部分缓解(PR)的患者中,中位缓解持续时间(DoR)为11.0[95%CI 4.0未达到(NR)] 个月,缓解时间(TTR)为1.7(范围1.2-8.4)个月。总体而言,64例患者(68.1%)存在无进展生存期(PFS)事件,所有患者的中位PFS为 4.4(95%CI 3.4-6.4)个月。
在66例疗效可评估的乳腺癌患者中,34例患者 (51.5%)达到客观反应,51例患者(77.3%,95%CI 65.3-86.7)得到控制。所有乳腺癌患者的中位PFS,为 6.4(95%CI 4.1-8.5)个月。52例患者(78.8%)有一定程度的肿瘤缩小,其中,36例患者目标病灶直径总和减少≥30%。
乳腺癌患者的预先指定亚组分析显示,几个预后亚组的反应一致,除了接受抗HER2 ADC预处理的患者的客观缓解率(ORR)和疾病控制率(DCR)(ORR:40.9% [9/22,95%CI 20.7-63.6],DCR:63.6% [14/22,95%CI 40.7-82.8])略低于接受曲妥珠单抗预处理的患者(ORR:53.1% [34/64,95%CI 40.2–65.7], DCR:79.7% [51/64,95%CI 67.8–88.7])、帕妥珠单抗 (ORR:53.6% [15/28,95%CI 33.9–72.5], DCR:78.6% [22/28,95%CI 59.0–91.7])和抗HER2酪氨酸激酶抑制剂(ORR:49.2%(29/59,95%CI 35.9–62.5),DCR:76.3% [45/59,95%CI 63.4–86.4]) 。脑转移患者(64.3%,95%CI 35.1-87.2) 与肺转移 (58.1%,95%CI 39.1-75.5)、骨转移(54.8%, 95%CI 36.0-72.7)、肝转移(48.1%,95%CI 28.7-68.1)和其他转移(52.9%,95%CI 38.5-67.1)患者的ORR相似。
在结直肠癌和胃癌亚组的分析中,ORR分别为10.0%(1/10, 95%CI 0.3–44.5)、25.0%(2/8, 95%CI 3.2–65.1),DCR分别为30.0%(3/10, 95%CI 6.7–65.2)、50.0%(4/8,95%CI 15.7–84.3)。
此外,在唾液腺癌患者(n = 1)和小肠癌患者(n = 1)中,也观察到PR。
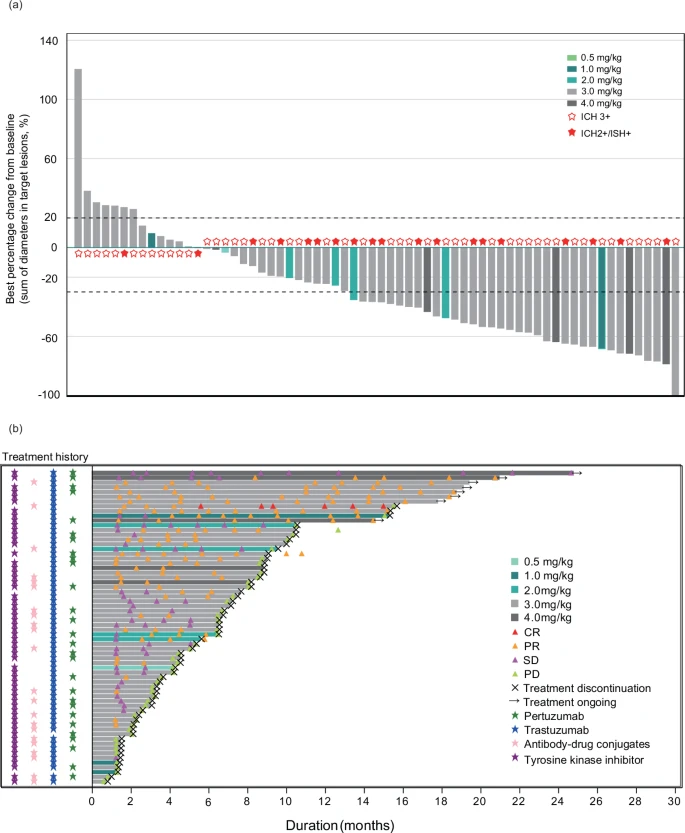
乳腺癌患者的肿瘤反应。
药代动力学和免疫原性分析
在首次以1.0至4.0mg/kg的剂量施用DP303c后,DP303c和总抗体在药代动力学特征上表现出相似性,其特征是相似的暴露水平、较长的半衰期和低清除率。在3.0mg/kg的剂量水平下,t1/2DP303c和总抗体,分别为DP303c首次给药后2.98天和2.81天。
89例患者在1.0至4.0mg/kg的DP303c治疗后,获得免疫原性数据,仅在3.0mg/kg组中,观察到抗DP303c抗体(ADA)阳性,治疗后ADAs发生率为11.0%(8/73)。ADA阳性样本患者和ADA阴性样本患者,DP303c暴露无显著差异。

DP303c在剂量递增阶段的药代动力学特征。
研究结论
03
DP303c在既往治疗的HER2阳性晚期实体瘤患者中,显示出有希望的抗肿瘤活性和可接受的安全性,尤其是在HER2阳性乳腺癌中。结合DP303c的安全性、有效性和PK曲线,这项研究扩大到了3.0mg/kg Q3W,结果支持3.0mg/kg Q3W被确定为推荐的2期剂量 (RP2D)。
参考资料:
1.Costa, R. L. B., Brian, J. & Czerniecki, B. J. Clinical development of immunotherapies for HER2+ breast cancer: a review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer 6, 10 (2020).
2.Ahn, S., Woo, J. W., Lee, K. & Park, S. Y. HER2 status in breast cancer: changes in guidelines and complicating factors for interpretation. J. Pathol. Transl. Med. 54, 34–44 (2020).
 腾讯登录
腾讯登录




还没有人评论,赶快抢个沙发