曹雪涛院士团队再发文:改善癌症免疫治疗的潜在靶点
| 导读 | 肿瘤细胞发展出多种机制来促进其免疫逃避。确定支持免疫逃避的肿瘤内在因素可能为癌症免疫治疗提供新的策略。 |
2024年10月14日,中国医学科学院曹雪涛院士团队在期刊《Journal of Hematology & Oncology》发表了题为“NPM1 inhibits tumoral antigen presentation to promote immune evasion and tumor progression”的研究论文,该研究发现NPM1抑制肿瘤抗原呈递,促进免疫逃避和肿瘤进展。在各种人类肿瘤中,高水平的NPM1表达预示着低存活率。NPM1的缺失抑制了肿瘤的进展,提高了荷瘤小鼠的存活率。Npm1缺陷肿瘤显示CD8+ T细胞浸润和激活增加,同时免疫抑制细胞的存在减少。Npm1缺乏增加MHC-I和MHC-II分子和特异性T细胞杀伤。从机制上讲,NPM1与转录因子IRF1结合,然后隔离IRF1与Nlrc5和Ciita启动子的结合,抑制肿瘤细胞中IRF1介导的MHC-I和MHC-II分子的表达。综上所述,肿瘤固有的NPM1通过抑制IRF1介导的抗原呈递来促进肿瘤免疫逃避,从而损害肿瘤免疫原性并重新编程免疫抑制TME。该研究确定NPM1是改善癌症免疫治疗的潜在靶点。

https://jhoonline.biomedcentral.com/articles/10.1186/s13045-024-01618-6#auth-Xuetao-Cao-Aff1-Aff2
背景信息
01
恶性细胞已经进化出多种策略,通过逃避免疫系统的识别和抑制抗肿瘤反应来促进肿瘤进展,这是癌症公认的特征。许多肿瘤内在的改变促进了免疫逃避,导致对免疫检查点阻断(ICB)等免疫疗法的抵抗。这些改变包括降低肿瘤抗原性、丢失抗原呈递分子、干扰素信号通路缺陷以及实施免疫逃避的致癌信号通路。同时,外部因素,如重新编程的免疫抑制性肿瘤微环境(TME),也在逃避宿主免疫系统的监视和促进肿瘤进展方面发挥着重要作用。激活免疫抑制性TME可能改善肿瘤抗原性、T细胞浸润或反应以及癌症免疫疗法的疗效。因此,揭示支持肿瘤免疫逃避和重新编程免疫抑制性TME的隐藏机制有潜力极大地推进我们对肿瘤-宿主相互作用的理解,并提高免疫疗法的疗效。
核仁是核内一种常见的亚结构,主要功能是参与核糖体的生成。核糖体的生成通常在肿瘤细胞中被过度激活,这是100多年前发现的肿瘤的一个重要特征。核仁异常与多种病理情况有关,包括癌症。通过对核仁蛋白质组的质谱分析,已经鉴定出数百种核仁蛋白质,这些蛋白质的功能与发生在核仁内的生物过程相一致。核仁是无膜的动态结构,这反映在核仁蛋白质在该结构与周围核质之间活跃地穿梭流动。因此,核仁蛋白质有可能直接影响各种核功能。迄今为止,已观察到肿瘤中各种核仁蛋白质的异常表达和突变。然而,核仁蛋白质在肿瘤免疫逃逸中发挥的作用和机制尚不清楚。
Npm1缺乏会抑制体内肿瘤的生长
02
研究人员首先分析了TCGA数据库中公开可用的数据,以研究肿瘤进展情况。与非肿瘤样本相比,NPM1 mRNA在多种人类肿瘤类型中均有升高,包括COAD(结肠腺癌)、LIHC(肝细胞癌)、HNSC(头颈部鳞状细胞癌)、LUAD(肺腺癌)和KIRP(肾乳头状细胞癌)。此外,总体生存分析表明,在多种人类肿瘤中,高水平的NPM1预示着较低的生存率。这些结果表明,NPM1促进人类肿瘤进展。
为了阐明NPM1对肿瘤进展和抗肿瘤免疫反应的影响,研究人员利用CRISPR-Cas9系统敲除了三种小鼠肿瘤细胞系(结肠癌MC38、黑色素瘤B16F10和肺癌LLC)中的Npm1基因。通过免疫印迹确认了敲除效率。然后将野生型或Npm1缺陷的肿瘤细胞通过皮下注射注射到同种野生型小鼠体内,并监测肿瘤生长。研究人员发现,在MC38、B16F10和LLC肿瘤细胞中失去NPM1显著降低了肿瘤生长,并延长了肿瘤小鼠的生存时间,与对照组相比。因此,Npm1缺乏在多种小鼠肿瘤模型中显著抑制肿瘤生长,为NPM1在体内促进肿瘤进展提供了额外的证据。
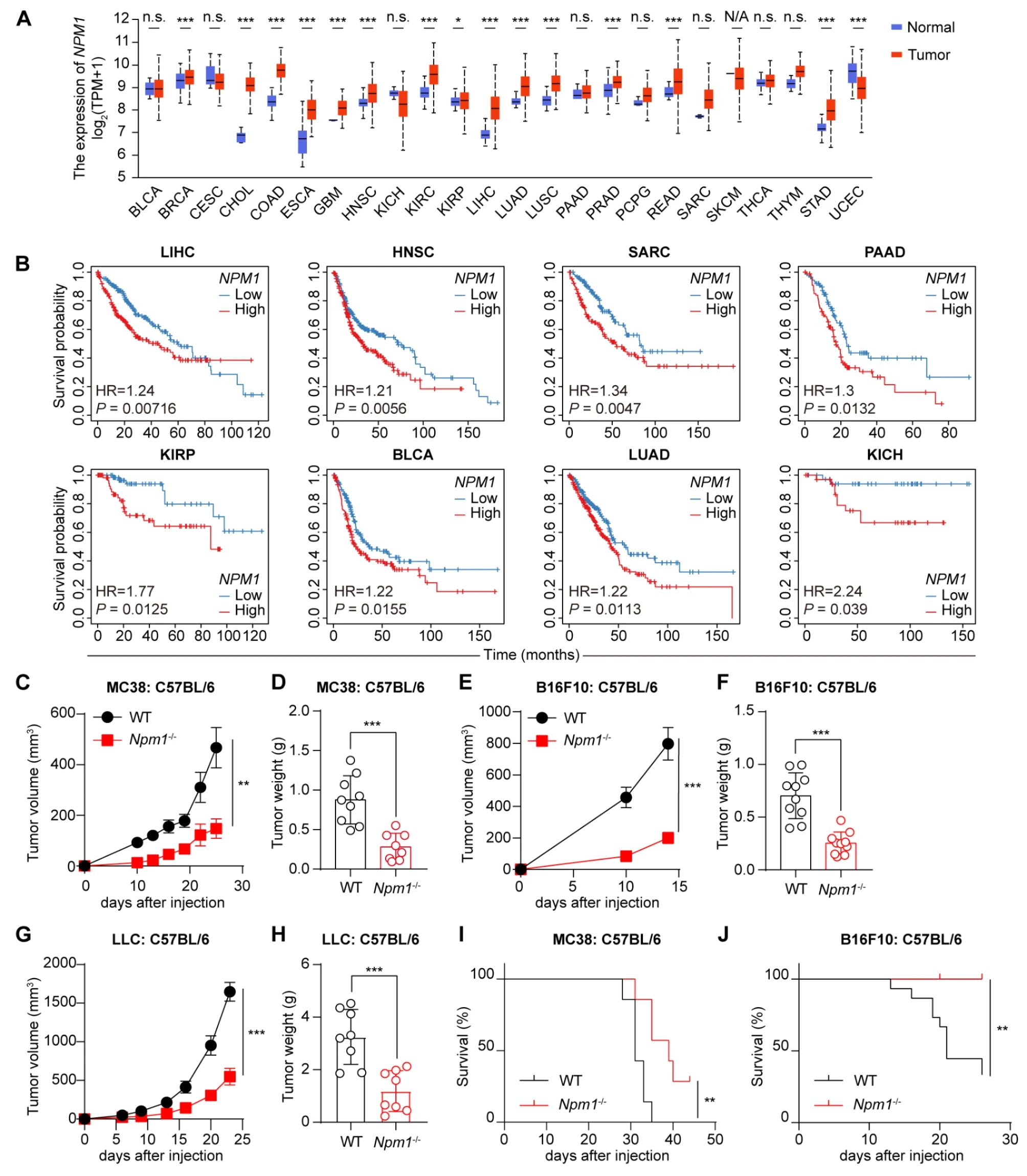
NPM1与人类和小鼠肿瘤的进展有关
Npm1缺乏促进CD8+T细胞进入肿瘤
03
流式细胞术分析证实,与对照组相比,Npm1缺失的MC38肿瘤和LLC肿瘤中CD45+免疫细胞浸润和CD4+T细胞、CD8+T细胞的比例增加。同时,MC38肿瘤和LLC肿瘤中自然杀伤细胞(NKs)和树突状细胞(DCs)的比例没有显著差异;只有LLC肿瘤中髓系抑制细胞(MDSCs)的比例在流式细胞术分析中减少。免疫组织化学(IHC)染色证实,Npm1缺失的MC38肿瘤中CD8+T细胞浸润显著增加。
为了确定增强的CD8+T细胞渗透对缺乏Npm1的肿瘤抑制作用的贡献,研究人员使用了一种基于抗体的CD8+T细胞耗竭方法,发现CD8+T细胞耗竭显著消除了缺乏Npm1的肿瘤的生长延迟。
此外,为了考虑肿瘤大小引起的偏差,研究人员在同一天将野生型和Npm1-缺乏的肿瘤细胞皮下注射,并在5天后分别切除以使实验终点时的肿瘤大小相等。随后的CyTOF分析重现了免疫细胞在TME中的渗透差异,包括CD8+ T细胞、CD4+ T细胞和DCs的显著富集,以及与对照组相比,Npm1-缺乏肿瘤中几种肿瘤相关巨噬细胞(TAM)亚群数量的减少。
这些结果进一步证明,Npm1缺乏会通过促进CD8+T细胞的浸润来重新编程免疫原性肿瘤微环境,从而控制Npm1缺乏肿瘤的生长。
结论
04
本研究结果揭示了核仁蛋白NPM1以前未被发现的特性,即通过抑制IRF1-介导的Nlrc5和Ciita转录,促进肿瘤进展和免疫逃避,最终抑制肿瘤细胞MHC-I和MHC-II的表达,降低肿瘤的免疫原性。Npm1-缺陷的肿瘤显示出更高的CD8+T细胞和CD4+T细胞浸润,以及更少的免疫抑制细胞,这表明NPM1在重编程免疫抑制性TME方面发挥着关键作用。
本研究结果指出了改善免疫疗法效果的有希望的靶点,并揭示了核仁蛋白作为肿瘤内在因素如何重编程TME并促进肿瘤免疫逃避。(转化医学网360zhyx.com)
【参考资料】
https://jhoonline.biomedcentral.com/articles/10.1186/s13045-024-01618-6#auth-Xuetao-Cao-Aff1-Aff2
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发