如何在实验中提高电转效率?干货技巧,助您实现轻松电转!(文末互动有福利)
| 导读 | 文末互动有福利! |
在之前的“转染方法如何选”中,物、化、生三大类转染方法的优缺点已进行总结归纳,下面是复习时间:
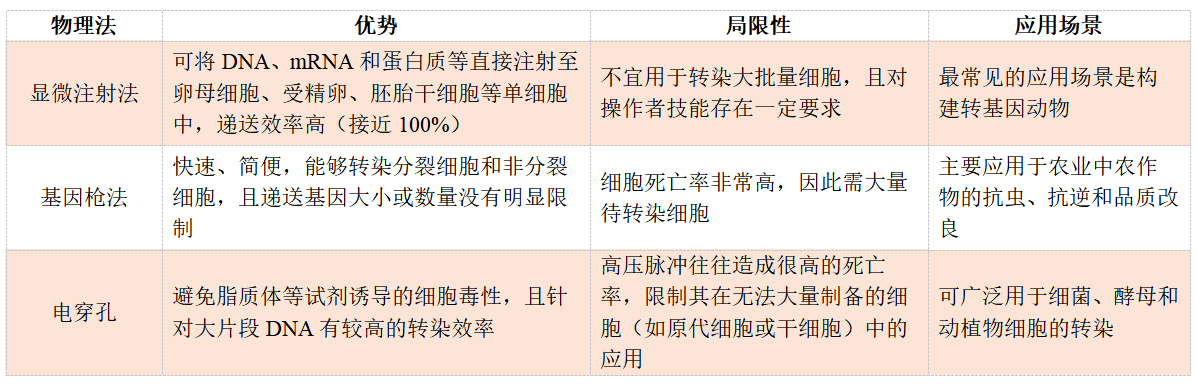

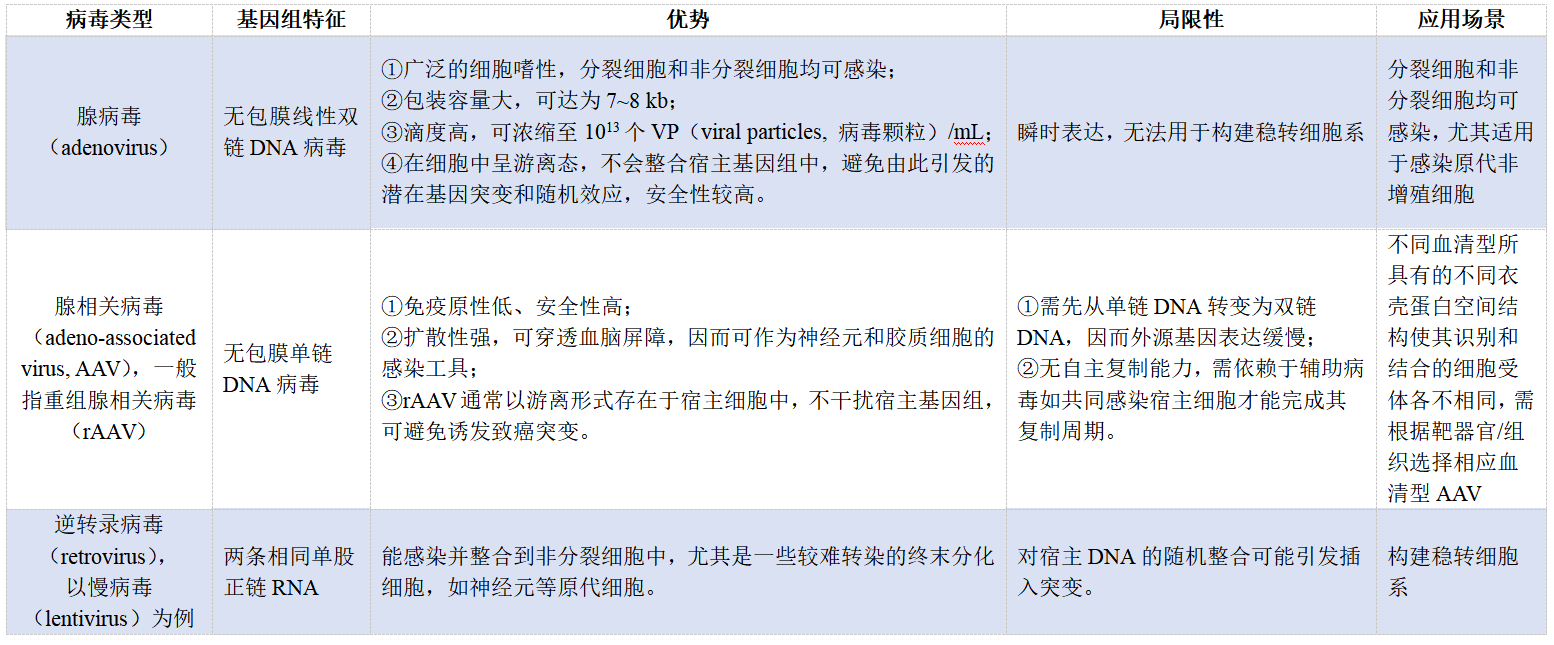
那么电穿孔,即我们常说的“电转”,是实验室中除了病毒转染、脂质体或PEI转染外使用较为普遍的一种物理转染方法。
对于电转方法的使用,有人说它们能够高效转染难以转染的细胞如神经元、免疫、原代细胞等,同时在现阶段大热的应用中,如基因编辑、CRISPR筛选,甚至于近年来新型崛起的合成生物学和AI制药研发中,都常能看到电转技术的应用。
而作为获得今年生物技术领域全球第四大的私募融资的实体瘤CAR-T明星公司Arsenal Biosciences,也是采用了非病毒载体的基因编辑CITE技术(CRISPR Integration of Transgenes by Electroporation),即用电穿孔手段实现T细胞的转基因CRISPR整合技术,使T细胞有选择性地靶向肿瘤,从而使患者的免疫系统能够在不破坏正常组织的情况下摧毁ccRCC细胞(clear-cell renal cell carcinoma)。
那么如何在实验中提高电转效率,想必是大家最关心的问题,今天小编请到了电转技术大户Lonza的专家为大家总结了以下八点:
1.准备好加了新鲜培养基的多孔板,并在实验前于37°C下预平衡
2.使用传代次数少并具有推荐融合度或密度(对数生长期)的细胞
3.针对于贴壁细胞,需限制胰蛋白酶暴露时间,仔细监测细胞分离情况
4.根据优化方案进行细胞计数并使用适量细胞数;所用细胞过少可能导致细胞死亡率增加,所用细胞过多可能导致细胞电转效率降低
5.采用高质量DNA,使用内毒素去除试剂盒进行纯化;请通过测定A260:A280比值检查各质粒制备液的纯度
6.室温下以离心速度80-100×g和方案规定的时间进行离心
7.离心后加入Nucleofector™溶液,混匀溶液/细胞沉淀制备成单细胞悬液,避免对细胞沉淀进行额外操作或用移液器枪头重复抽吸
8.Nucleofection™核转后,用核转试剂盒内配的一次性移液管在电转耗材中的细胞顶部加入约500μL预热培养基
♦ 轻轻将一次性移液管吸头置于电转耗材底部,收集细胞
♦ 将细胞悬液轻轻接种至制备的多孔板中
♦ 请勿重复吹吸混合细胞
希望以上精心提炼的小技巧能帮助到各位的日常实验。
提到Lonza知名的NucleofectorTM核转系统,大家应该早已不陌生。使用范围之广,在Google Scholar用“Nucleofector”来检索,已经有42,100+篇文献提及Nucleofector™技术,数量每日递增中。
而Lonza 4D NucleofectorTM平台从实际需求出发,开发了从低通量到高通量,小体积到大体积的电转染,研发到生产规模的设备型号,保证从小体系筛选到大规模电转的可行性和放大工艺可转移。包括如下功能模块并匹配对应应用方向:
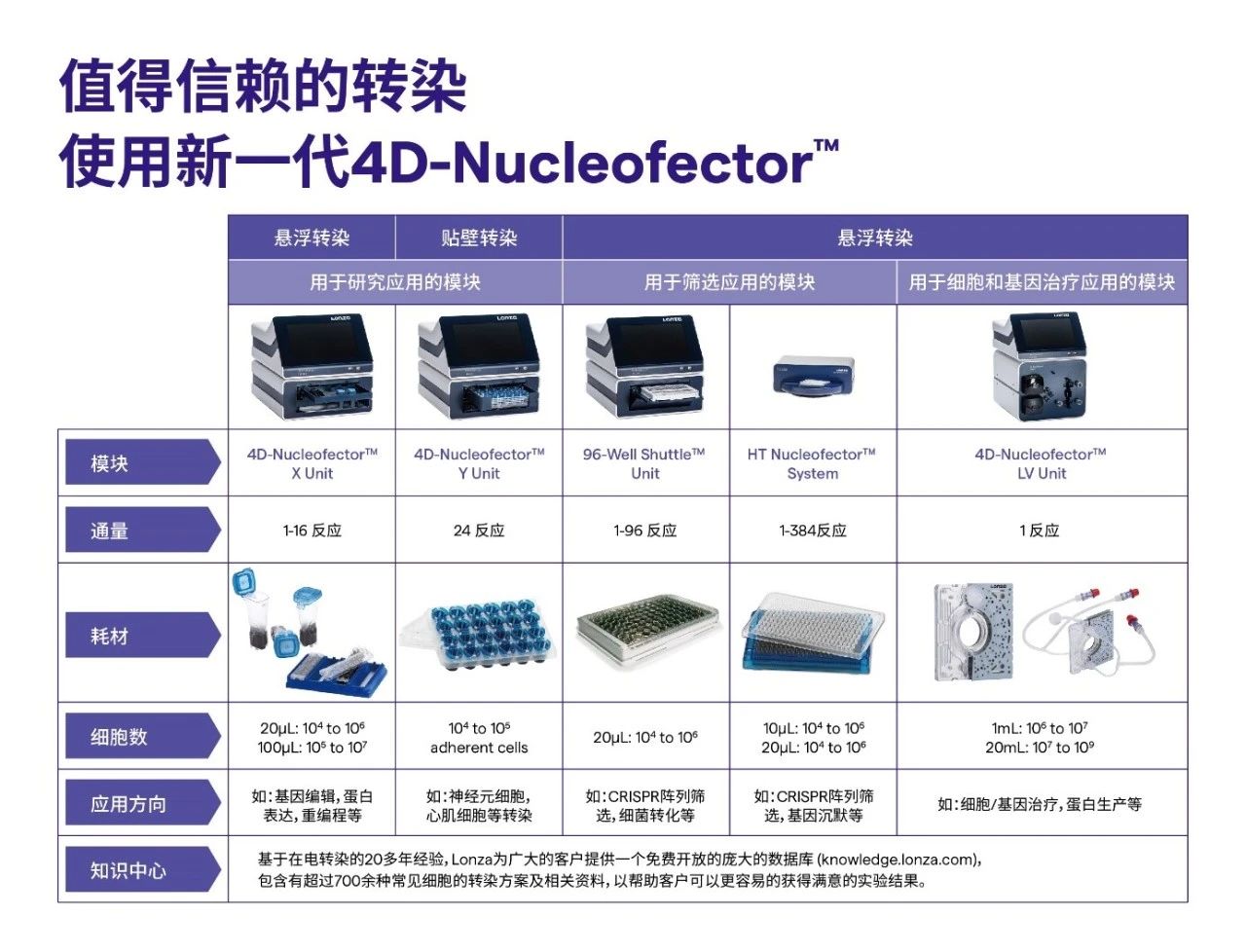
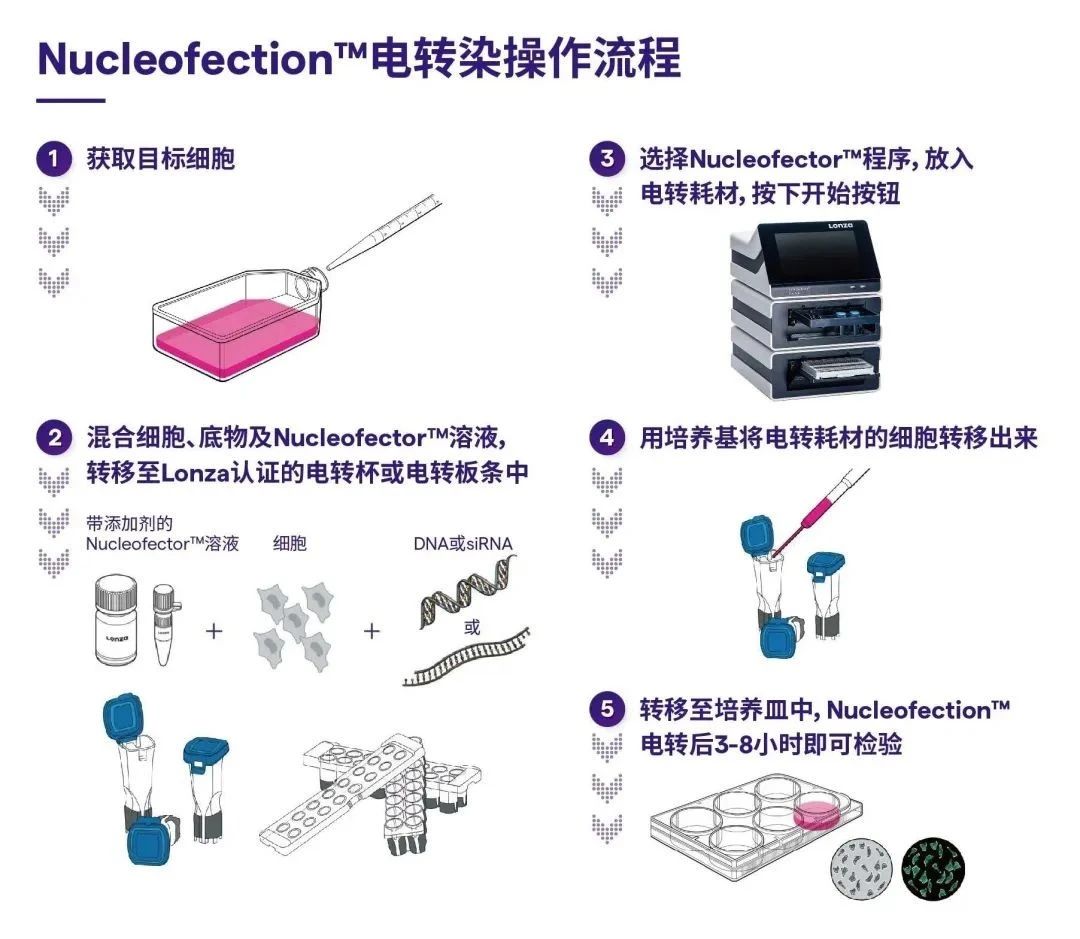
并且只需5步简单的操作方案,
即可实现轻松电转!

互动有礼
在评论区说出你使用NucleofectorTM转染过哪些细胞,或谈谈你的使用心得,我们将在下周三前挑选5名留言赠送Lonza定制雨伞一把(颜色随机)!

想要了解更多NucleofectorTM相关信息?扫码获取产品手册。

 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发