Cell:科学家从下丘脑“揪出”体重控制基因—SEMA3A
| 导读 | 医学界将肥胖定义为是一种常见的、明显的、复杂的代谢失调症,表现为机体脂肪组织量过多或脂肪组织与其他软组织的比例过高,病因非常复杂,神经因素多归咎于拥有体重“调定点”的下丘脑病变。但关于下丘脑究竟引发肥胖的机制至今仍众说纷纭。 |
医学界将肥胖定义为是一种常见的、明显的、复杂的代谢失调症,表现为机体脂肪组织量过多或脂肪组织与其他软组织的比例过高,病因非常复杂,神经因素多归咎于拥有体重“调定点”的下丘脑病变。但关于下丘脑究竟引发肥胖的机制至今仍众说纷纭。近日,美国洛杉矶儿童医院和英国剑桥大学代谢研究实验室的研究人员合作在下丘脑找出了一组与体重控制有关的重要分子—SEMA3A及其受体家族,这些分子形成的信号通路对神经环路的正确塑造至关重要,可调节机体能量平衡,若这条信号通路被干扰,就可能造成严重肥胖。
肥胖患者广泛存在SEMA3A相关突变

SEMA3A基因是semaphorin家族的成员,编码具有Ig样C2型(免疫球蛋白样)结构域、PSI结构域和Sema结构域的分泌蛋白。SEMA3A可作为信号分子,相关分子在下丘脑中大量表达,在中枢神经系统发育过程中具有轴突导向和引导神经细胞迁移的作用。
在约600名早发性肥胖症患者中,研究人员发现13个编码SEMA3A及其受体家族PlexinA和NRP的基因中共出现了40个基因突变(包括SEMA3、 PLXNA1-4及NRP1-2等相关突变)。与健康人群基因组对比后证实SEMA3A信号通路的相关基因突变在肥胖患者中广泛存在。那么,这些基因突变会不会就是肥胖的元凶呢?
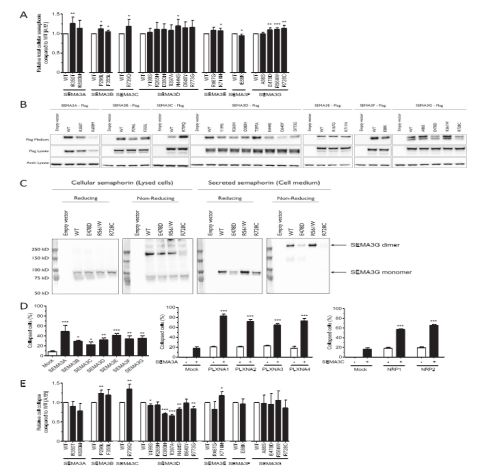
肥胖患者中存在着大量突变SEMA3
统筹能量摄取消耗的SEMA3A信号通路
SEMA3A及其受体在下丘脑的分布很有意思。SEMA3A主要分布在下丘脑的室旁核,而受体蛋白则多表达于弓状核,这两个核团有什么用呢? 在下丘脑中,神经肽Y(NPY,一种调控动物采食量的内源因子)在弓状核合成,通过轴突输送到室旁核,经室旁核分泌而参与摄食的调节,而室旁核、弓状核同时存在瘦素受体,有助于发挥下丘脑的神经内分泌调控作用。换言之,室旁核和弓状核的信息交流与机体能量的摄取和消耗密切相关,而遍布其中的SEMA3A及其受体自然不会仅是摆设。
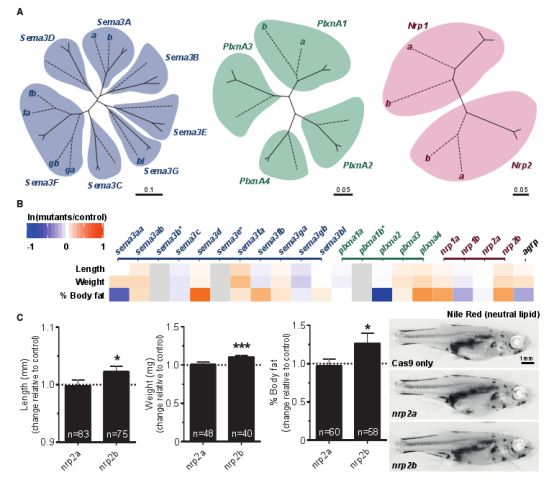
敲除SEMA3A信号通路相关基因后斑马鱼体重显著增长
研究人员发现敲除SEMA3A信号通路中的某些基因后可导致斑马鱼变胖!而且不仅仅是体重增加,连体脂百分比也大幅上涨!同时,他们发现在人和小鼠的胎儿至刚成年时期,SEMA3A及其受体在下丘脑大量表达,而这段时间恰好是机体能量调控相关神经环路的关键发育窗口!也就是说,SEMA3A信号通路相关基因的突变应该与肥胖存在某种联系。
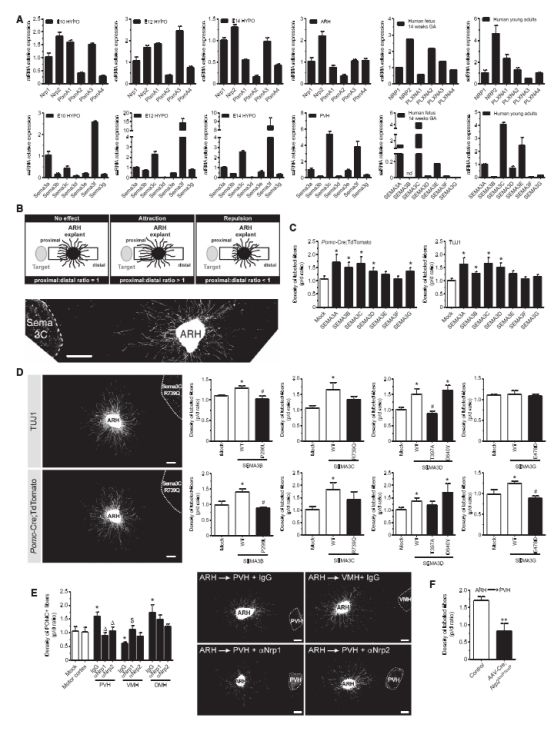
SEMA3在下丘脑中的表达
进一步的体外实验显示,在室旁核、弓状核神经元的的信息交流中,SEMA3A蛋白可以吸引有受体表达的神经元生长,从而引导核团神经元朝特定方向发展。简而言之,SEMA3A正是指导室旁核、弓状核神经元发展方向,进而决定神经环路发育布局,最终统筹机体能量的摄取和消耗的“军师”。一旦相应基因发生突变,“军师”就无法与军队互相识别(神经间投射减少),导致神经环路的发育受到抑制,能量摄入增加伴消耗减少,肥胖自然不期而至。
更好玩的是,基因敲除的实验动物与健康动物的进食量是没有差别的,而这些实验动物无一例外都成为了“胖子”。也就是说,即使控制能量摄入,只要SEMA3A信号通路的相关基因有了差错,能量平衡系统失控,能量消耗就会相应减少,“喝口水都胖”就是常态了。
那是不是意味着减肥就没有意义了呢?当然不是。肥胖是一种严重的代谢疾病,如果不加以管理,随之而来的可不仅仅是体态的臃肿,各大威胁生命的疾病也会纷至沓来。“管住嘴迈开腿”仍然是肥胖患者必须遵守的原则。而这项研究为重度肥胖症患者提供了一个全新治疗方向,希望在不远的将来,肥胖难题能迎刃而解。
参考文献:
Sadaf Farooqi.et al.Human Semaphorin 3 Variants Link Melanocortin Circuit Development and Energy Balance. Cell..
Obesity-Regulating Brain Signaling Pathway Genes Identified
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发