Science:谷氨酰胺拮抗剂——“代谢检查点”广谱抗癌药曙光初现
| 导读 | 肿瘤代谢改变可作为肿瘤药物开发的靶点。近日,约翰·霍普金斯大学研究人员开发了一种可阻断谷氨酰胺代谢的化合物,该化合物可抑制肿瘤生长,改变肿瘤微环境,并可改变T细胞代谢,引起持续而强烈的抗肿瘤反应。 |

肿瘤代谢改变可作为肿瘤药物开发的靶点。近日,约翰·霍普金斯大学研究人员开发了一种可阻断谷氨酰胺代谢的化合物,该化合物可抑制肿瘤生长,改变肿瘤微环境,并可改变T细胞代谢,引起持续而强烈的抗肿瘤反应。

肿瘤细胞具有特殊的营养和代谢需求,其代谢通路也发生了改变。具有代表性的是Warburg效应,即对大量的葡萄糖进行糖酵解并产生乳酸,以提供足够的ATP和NAD+。另外,谷氨酰胺也在提供碳源和氮源中起重要作用。谷氨酰胺能够通过TCA循环产生代谢中间物,以合成生长必须的脂质、蛋白和核酸。
该药物是一种谷氨酰胺拮抗剂DON的前体药物。谷氨酰胺代谢存在于所有细胞中,但是,DON前体药物可选择性的靶向谷氨酰胺依赖性的肿瘤细胞。因此,理论上,该药物可应用于不同类型的癌症。
首先,Powell及其同事构建了几种小鼠肿瘤模型,包括结肠癌、淋巴瘤、黑色素瘤,以测试DON前体药物——JHU083。
在最初的设想中,Powell希望该药物阻断肿瘤细胞谷氨酰胺代谢后,可以达到两种效果:抑制肿瘤生长,改变肿瘤微环境。因为肿瘤代谢异常,往往呈酸性、缺氧且营养缺乏,这种微环境对于免疫细胞的生存和发挥杀伤功能是非常不利的。
动物实验结果表明,JHU083可通过改变肿瘤代谢来改变肿瘤微环境,使T细胞恢复功能,进而导致肿瘤消退。而且,对于那些肿瘤消退的小鼠,重新注射肿瘤细胞后,这些小鼠都未形成肿瘤,说明经过JHU083治疗后的小鼠形成了免疫记忆。
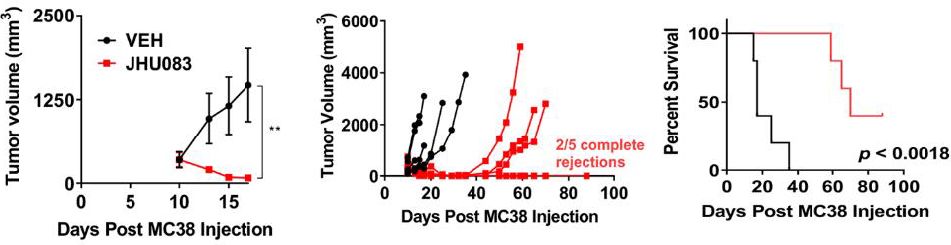
动物实验中,谷氨酰胺拮抗剂JHU083可使肿瘤体积缩小、生存期延长
他们也测试了JHU083联合免疫检查点药物PD-1的效果,最初,他们担心如果同时使用两种药物,代谢阻断不仅会影响肿瘤细胞,也会对T细胞代谢产生不良影响,进而影响免疫检测点药物的效果。然而,他们惊讶的发现,同时使用两种药物的抗肿瘤效果要远远好于单独使用PD-1。
进一步的研究发现JHU083并没有抑制T细胞功能,反而对T细胞有强烈而直接的增强作用。为探索其原因,他们对效应T细胞和肿瘤细胞进行了基因表达分析和比较,发现了二者代谢差异巨大,而且这些差异是由于谷氨酰胺拮抗剂引起的。
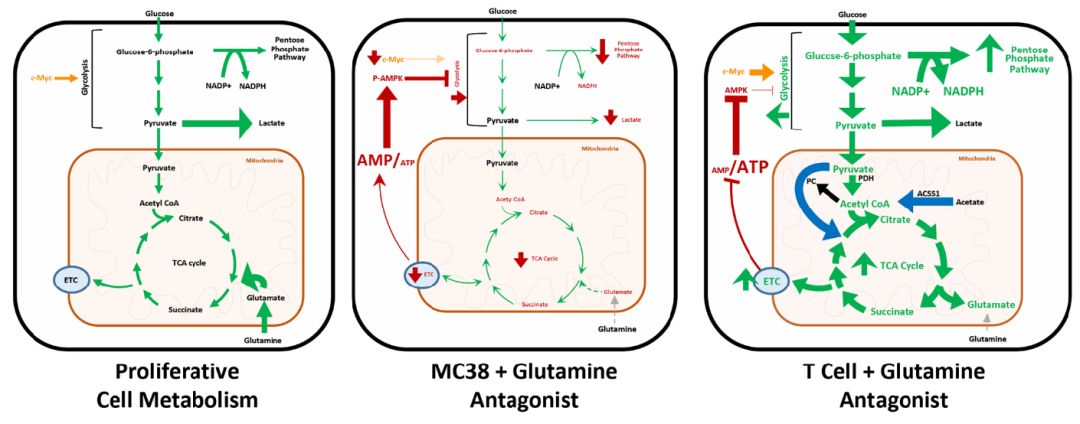
谷氨酰胺拮抗剂导致CD8+T细胞TCA循环增强(右图),肿瘤细胞MC38的TCA循环减弱(中间),左图为快速增殖细胞的代谢通路示意图
这些谷氨酰胺拮抗剂导致的代谢变化使得肿瘤浸润T细胞能够长期的、有效的杀伤肿瘤细胞,而非处于耗竭状态。Powell说,“通过阻断谷氨酰胺代谢,这些T细胞的作用更加持久,而且更像记忆性细胞。”
既然JHU083可增强细胞治疗效果,说明这种新方法可用来增强CAR-T等免疫细胞的疗效,因此在一些免疫细胞联合治疗中很有意义。
JHU083通过对T细胞和肿瘤细胞不同的代谢通路的调节,从而对T细胞的增强和对肿瘤细胞抑制。这种T细胞和肿瘤细胞代谢通路的巨大差异可作为新的靶点,以开发新的代谢拮抗剂。而且,即使一些肿瘤细胞代谢通路发生改变,比如对JHU083产生了耐药性,也可以通过另外一种代谢拮抗剂来避免逃逸。
参考文献:
Robert D. Leone et al, Glutamine blockade induces divergent metabolic programs to overcome tumor immune evasion, Science (2019). DOI: 10.1126/science.aav2588
https://medicalxpress.com/news/2019-11-glutamine-blocking-drug-tumor-growth-anti-tumor.html
推荐阅读:
-
第三届现代临床分子诊断研讨会&第四届精准医学高峰论坛开幕!
-
强强联手!新组合用药有望“创造”靶点,实现对癌症“围追堵截”
-
这些被忽视的免疫细胞,竟是乳腺癌细胞治疗的“潜力股”!
-
Science子刊:深挖“双面蛋白”沦为肿瘤免疫逃逸帮凶的真相
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发