新发现!复旦大学中山医院:发现癌转移治疗新策略
| 导读 | 淋巴结转移(LNM)有助于远处肿瘤的侵袭,是导致原发性肝内胆管癌(ICC)患者死亡率高的重要原因。然而,ICC细胞是如何在原发肿瘤免疫微环境中逃避免疫监视并进而转移到淋巴结(LNs)的,目前仍不清楚。 |
6月26日,复旦大学中山医院研究团队在期刊《Cell Death Discovery》上发表了研究论文,题为“Mobilization and activation of tumor-infiltrating dendritic cells inhibits lymph node metastasis in intrahepatic cholangiocarcinoma”。本研究发现,肿瘤细胞内源性β-连环蛋白激活是ICC中LNM时破坏DC介导的抗肿瘤免疫的关键机制。FL-pIC疗法或β-连环蛋白抑制剂可能值得作为一种潜在的方案来缓解ICC细胞向LN的转移并实现有效的肿瘤免疫控制。

https://www.nature.com/articles/s41420-024-02079-z#Sec9
研究背景
01
肝内胆管癌(ICC)约占原发性肝癌的10-20%,在过去20年中全球范围内的发病率和死亡率均呈上升趋势。手术切除是ICC唯一的潜在治愈方法,但术后5年生存率仍然很低,主要是由于肿瘤复发率较高。其中,淋巴结转移(LNM)是ICC患者进行根治性切除后最常见的风险因素之一,已被证实与快速肿瘤复发和不良长期生存有关。根据美国联合委员会癌症分期系统(AJCC)第8版TNM分期方案,ICC中LNM的存在表明肿瘤处于更晚期。然而,肿瘤向淋巴结转移的分子机制尚不为人所知。对肿瘤微环境的全面分析有助于加深我们对LNM机制的理解,并为ICC设计更有效的抗癌疗法。
研究进展
02
研究人员将TLR3激动剂聚肌胞(poly(I:C))与Flt3L联合使用,促进Flt3L动员的DCs的成熟和激活。研究人员首先探索是否可以使用MuCCA1细胞构建足垫肿瘤LNM模型。然而,在第35天和第85天的体内动态成像显示,MuCCA1细胞的LNM潜力有限,因此不适合构建LNM模型,这可能是由于缺乏β连环蛋白信号激活的证据,即膜β连环蛋白IF染色。然后,研究人员转向了另一种从AKT/YAP诱导的ICC中建立的细胞系mIC-23,发现mIC-23细胞可以构建肿瘤LNM模型。此外,在AKT/YAP驱动的ICC病变和mIC-23足垫肿瘤中进行的YAP和β连环蛋白的IF染色显示,YAP和β连环蛋白同时在核内共定位,提示两者信号的完全激活。
研究人员接下来在体内使用mIC-23足垫肿瘤LNM模型研究联合FL-pIC疗法的治疗效果。将荧光素酶(Luc)-标记的mIC-23细胞植入足垫区域后,研究人员将小鼠随机分为2组(每组9只),并接受相应的治疗。体内生物荧光成像显示,与PBS组相比,FL-pIC疗法显著抑制了mIC-23肿瘤细胞向腘窝LN的转移。研究人员取出主要足垫肿瘤、腘窝LN和腹股沟LN。同样,FL-pIC治疗抑制了mIC-23足垫肿瘤的生长。研究人员还观察到与对侧正常LN相比,肿瘤引流的腘窝LN体积更大。腘窝LN的H&E染色和CK19免疫组化染色进一步证实,FL-pIC疗法显著抑制了LN转移,而不影响肿瘤引流的腘窝LN的大小。此外,腘窝LN的IF染色显示,转移的mIC-23细胞的核内有YAP和β-连环蛋白的阳性染色。
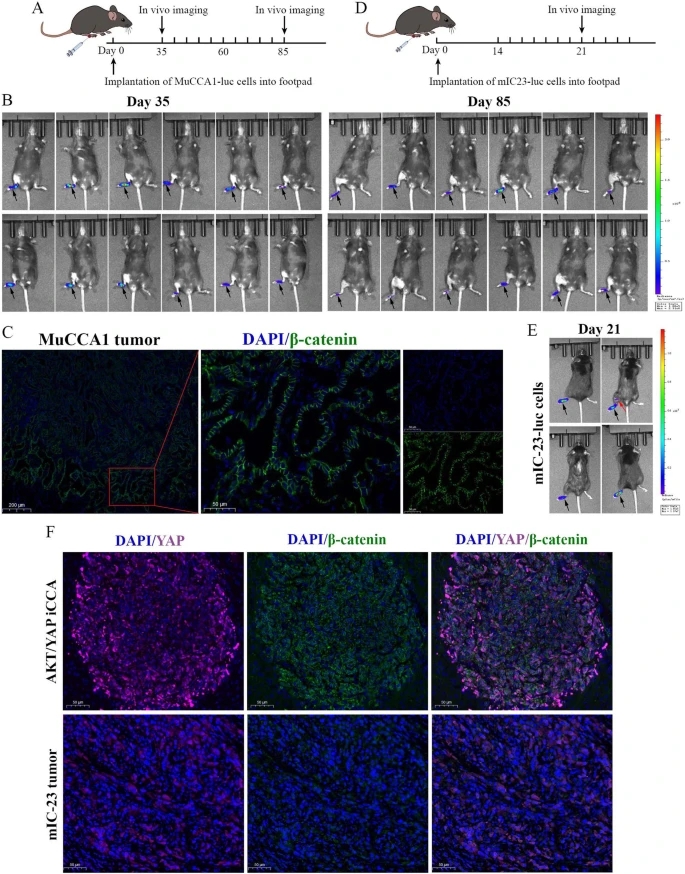
利用小鼠ICC细胞系构建足垫肿瘤LNM模型的探索
研究结论
03
综上,研究结果表明,β-连环蛋白激活导致DC被排斥进入ICC肿瘤微环境,并通过阻断CXCL12的产生来实现。在肿瘤内扩张和激活cDCs代表了一种有前途的治疗策略,有助于减轻肿瘤细胞向LNs的转移。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41420-024-02079-z#Sec9
 腾讯登录
腾讯登录


还没有人评论,赶快抢个沙发